|
1. Capacidad calorífica
2. Formas de transmisión del calor
3. Energía interna
6. Dilatación térmica de los cuerpos
7. Calor y trabajo 8. Leyes de la termodinámica
1. Primera ley
2. Segunda ley
3. Tercera ley
20. Cuestiones
21. Vídeos
|
1. ESQUEMAS

2. PRESENTACIONES


3. CONTENIDOS ANIMADOS




4. LA TEMPERATURA
Por medio del tacto notamos la temperatura al tocar un cuerpo ya que unas terminaciones nerviosas situadas en la piel se encargan de ello.
Vamos estudiar el comportamiento de un gas para tratar de asociar esta sensación a una magnitud (algo que podemos medir) y para comprender qué cualidades de la materia manifiesta.
Toda la materia está formada por partículas en continua agitación:. incluso los sólidos, que a simple vista parecen estar en reposo, la tienen.
En los sólidos las vibraciones son pequeñas. Si la energía de agitación es muy grande, se pueden llegar a romper los enlaces entre las moléculas y entre los átomos.
Las partículas se desenlazan y vibran libres, rotan, chocan entre si y contra las paredes del recipiente. Este estado de la materia se llama gaseoso. El gas trata de ocupar todo el volumen del recipiente que lo contiene: trata de expandirse.
No todas las partículas se mueven en la misma dirección y con la misma velocidad. A cada estado concreto se le puede asignar una velocidad media.
En un gas la temperatura es una magnitud (algo que podemos medir) que se relaciona con la medida de la velocidad media con que se mueven las partículas (por lo tanto con su energía cinética o nivel de agitación).
La temperatura no depende del número de partículas que se mueven sino de su velocidad media: a mayor temperatura mayor velocidad media. No depende por tanto de la masa total del cuerpo: si dividimos un cuerpo con una temperatura "T" en dos partes desiguales las dos tienen la misma temperatura.
La temperatura es una magnitud que refleja el nivel térmico de un cuerpo (su capacidad para ceder energía calorífica) y el calor es la energía que pierde o gana en ciertos procesos (es un flujo de energía entre dos cuerpos que están a diferentes temperaturas).
Nivel térmico es el nivel de agitación. Comparando los niveles térmicos sabemos hacia donde fluye el calor.
La temperatura refleja el nivel térmico de un cuerpo e indica el sentido en que fluye el calor.
¿Cómo se mide la temperatura?
Nuestro tacto detecta la temperatura, pero carece de la capacidad de medirla con rigor.

Introduce una mano en un recipiente frío y la otra en uno caliente, y luego las dos manos juntas en otro recipiente con agua templada.
La primera mano la encontrará caliente y la otra fría.
Del cuerpo que está a mayor temperatura decimos que "está más caliente" y a veces, erróneamente, se dice "que tiene más calor". Los cuerpos no tienen calor, tienen energía interna y tienen temperatura. Reservamos el término "calor" para la energía que se transfiere de un cuerpo a otro. Esta energía es fácil de medir, pero la energía total que tiene el cuerpo no.
Si un cuerpo recibe energía calorífica aumenta la agitación de las partículas que lo forman (átomos, moléculas o iones) y se pueden producir también cambios en la materia: dilatación, cambios de color (piensa en una barra de metal al calentarla), variación de su resistencia a la conducción, etc. Estos cambios se pueden utilizar para hacer una escala de temperatura.
Al poner en contacto dos sustancias la agitación de las partículas de una se transmite, mediante choques, a las partículas de la otra hasta que se igualan sus velocidades. Las partículas de la sustancia más caliente son más rápidas y poseen más energía. En cada impacto ceden parte de la energía a las partículas más lentas con las que entran en contacto. Las partículas de la sustancia que está a mayor T se frenan un poco, pero al mismo tiempo hacen que la más lentas aceleren.
Finalmente las partículas de las dos sustancias alcanzan la misma velocidad media y por lo tanto la misma temperatura: se alcanza el "equilibrio térmico".
Para diseñar un instrumento que mida la temperatura debemos escoger una cualidad de la materia que sea fácilmente observable, que varíe de manera importante con la agitación de sus partículas, que sea fácil de medir y que nos permita relacionar su variación con la agitación que tiene el cuerpo.
La cualidad elegida en los termómetros de mercurio es la dilatación, pero existen otros tipos de termómetros basados en otras cualidades.
Se utiliza el mercurio para construir termómetros porque es un metal que es líquido entre -20 ºC y 100ºC y porque se dilata mucho. Encerramos el metal dentro de un tubo fino (capilar) para que al dilatarse un poco avance mucho por el tubo (cuanto más fino sea el tubo más centímetros avanza). Midiendo longitudes de la columna podemos establecer una relación entre la dilatación y el nivel de agitación de la sustancia a medir.




¡Medimos la temperatura midiendo una longitud!
Se pueden tomar como base para medir las temperaturas otras propiedades que cambien con ella como el color, la resistencia eléctrica, etc. Aparatos basados en las anteriores propiedades son el pirómetro óptico, el termopar....
Esto posibilita el medir en distintos rangos de temperaturas. Piensa en lo que pasaría si midieras la temperatura de un alto horno con un termómetro de mercurio.
4.1. Calibrado del termómetro. Escala Celsius de temperatura
Celsius, eligió como cero de temperatura para su escala la temperatura del hielo en contacto con agua. Las temperaturas inferiores, por lo tanto, serán negativas.
Para marcar ese punto en el termómetro, lo introducimos en una mezcla de agua y hielo y esperamos hasta que se estabilice la posición del mercurio de la columna. Marcamos ese punto en el vidrio (es el extremo de la columna de mercurio en ese momento) como punto 0.




Calentamos agua en un Erlenmeyer cerrado con un tapón bihoradado. Por un agujero del tapón sale un tubo y por él vapor, por el otro introducimos el termómetro. Se inserta hasta que el bulbo quede en un punto próximo a la superficie del agua.
La columna de mercurio sube pero cuando el agua empieza a hervir se para y no sube más. Marcamos el vidrio en ese punto como punto 100. Si la presión no es 1 atm. la temperatura de ebullición no será 100 ºC.
Dividimos la longitud del vidrio entre 0 y 100 en 100 partes iguales. A cada división le corresponde 1 grado centígrado.
Con el termómetro de mercurio medimos la temperatura del aire. Este es el dato climatológico más conocido.
Vamos estudiar el comportamiento de un gas para tratar de asociar esta sensación a una magnitud (algo que podemos medir) y para comprender qué cualidades de la materia manifiesta.
Toda la materia está formada por partículas en continua agitación:. incluso los sólidos, que a simple vista parecen estar en reposo, la tienen.
En los sólidos las vibraciones son pequeñas. Si la energía de agitación es muy grande, se pueden llegar a romper los enlaces entre las moléculas y entre los átomos.
Las partículas se desenlazan y vibran libres, rotan, chocan entre si y contra las paredes del recipiente. Este estado de la materia se llama gaseoso. El gas trata de ocupar todo el volumen del recipiente que lo contiene: trata de expandirse.
No todas las partículas se mueven en la misma dirección y con la misma velocidad. A cada estado concreto se le puede asignar una velocidad media.
En un gas la temperatura es una magnitud (algo que podemos medir) que se relaciona con la medida de la velocidad media con que se mueven las partículas (por lo tanto con su energía cinética o nivel de agitación).
La temperatura no depende del número de partículas que se mueven sino de su velocidad media: a mayor temperatura mayor velocidad media. No depende por tanto de la masa total del cuerpo: si dividimos un cuerpo con una temperatura "T" en dos partes desiguales las dos tienen la misma temperatura.
La temperatura es una magnitud que refleja el nivel térmico de un cuerpo (su capacidad para ceder energía calorífica) y el calor es la energía que pierde o gana en ciertos procesos (es un flujo de energía entre dos cuerpos que están a diferentes temperaturas).
Nivel térmico es el nivel de agitación. Comparando los niveles térmicos sabemos hacia donde fluye el calor.
La temperatura refleja el nivel térmico de un cuerpo e indica el sentido en que fluye el calor.
¿Cómo se mide la temperatura?
Nuestro tacto detecta la temperatura, pero carece de la capacidad de medirla con rigor.
Introduce una mano en un recipiente frío y la otra en uno caliente, y luego las dos manos juntas en otro recipiente con agua templada.
La primera mano la encontrará caliente y la otra fría.
Del cuerpo que está a mayor temperatura decimos que "está más caliente" y a veces, erróneamente, se dice "que tiene más calor". Los cuerpos no tienen calor, tienen energía interna y tienen temperatura. Reservamos el término "calor" para la energía que se transfiere de un cuerpo a otro. Esta energía es fácil de medir, pero la energía total que tiene el cuerpo no.
Si un cuerpo recibe energía calorífica aumenta la agitación de las partículas que lo forman (átomos, moléculas o iones) y se pueden producir también cambios en la materia: dilatación, cambios de color (piensa en una barra de metal al calentarla), variación de su resistencia a la conducción, etc. Estos cambios se pueden utilizar para hacer una escala de temperatura.
Al poner en contacto dos sustancias la agitación de las partículas de una se transmite, mediante choques, a las partículas de la otra hasta que se igualan sus velocidades. Las partículas de la sustancia más caliente son más rápidas y poseen más energía. En cada impacto ceden parte de la energía a las partículas más lentas con las que entran en contacto. Las partículas de la sustancia que está a mayor T se frenan un poco, pero al mismo tiempo hacen que la más lentas aceleren.
Finalmente las partículas de las dos sustancias alcanzan la misma velocidad media y por lo tanto la misma temperatura: se alcanza el "equilibrio térmico".
Para diseñar un instrumento que mida la temperatura debemos escoger una cualidad de la materia que sea fácilmente observable, que varíe de manera importante con la agitación de sus partículas, que sea fácil de medir y que nos permita relacionar su variación con la agitación que tiene el cuerpo.
La cualidad elegida en los termómetros de mercurio es la dilatación, pero existen otros tipos de termómetros basados en otras cualidades.
Se utiliza el mercurio para construir termómetros porque es un metal que es líquido entre -20 ºC y 100ºC y porque se dilata mucho. Encerramos el metal dentro de un tubo fino (capilar) para que al dilatarse un poco avance mucho por el tubo (cuanto más fino sea el tubo más centímetros avanza). Midiendo longitudes de la columna podemos establecer una relación entre la dilatación y el nivel de agitación de la sustancia a medir.
¡Medimos la temperatura midiendo una longitud!
Se pueden tomar como base para medir las temperaturas otras propiedades que cambien con ella como el color, la resistencia eléctrica, etc. Aparatos basados en las anteriores propiedades son el pirómetro óptico, el termopar....
Esto posibilita el medir en distintos rangos de temperaturas. Piensa en lo que pasaría si midieras la temperatura de un alto horno con un termómetro de mercurio.
4.1. Calibrado del termómetro. Escala Celsius de temperatura
Celsius, eligió como cero de temperatura para su escala la temperatura del hielo en contacto con agua. Las temperaturas inferiores, por lo tanto, serán negativas.
Para marcar ese punto en el termómetro, lo introducimos en una mezcla de agua y hielo y esperamos hasta que se estabilice la posición del mercurio de la columna. Marcamos ese punto en el vidrio (es el extremo de la columna de mercurio en ese momento) como punto 0.
Calentamos agua en un Erlenmeyer cerrado con un tapón bihoradado. Por un agujero del tapón sale un tubo y por él vapor, por el otro introducimos el termómetro. Se inserta hasta que el bulbo quede en un punto próximo a la superficie del agua.
La columna de mercurio sube pero cuando el agua empieza a hervir se para y no sube más. Marcamos el vidrio en ese punto como punto 100. Si la presión no es 1 atm. la temperatura de ebullición no será 100 ºC.
Dividimos la longitud del vidrio entre 0 y 100 en 100 partes iguales. A cada división le corresponde 1 grado centígrado.
Con el termómetro de mercurio medimos la temperatura del aire. Este es el dato climatológico más conocido.
4.2. Escalas termométricas
Para medir la magnitud temperatura se utilizan diversas escalas:
Escala Celsius o centígrada
Creada por Anders Celsius, es la escala más utilizada internacionalmente. En esta escala se elige la temperatura de congelación del agua para ubicar el 0 y la temperatura de ebullición del agua para colocar el 100 . Un grado centígrado (ºC) es pues la centésima parte de esa diferencia de temperaturas.
Escala Kelvin o absoluta .
Es la escala de temperatura absoluta, creada por William Thomson. En esta escala se ubica el 0 en la temperatura más baja (-273 ºC) que puede existir en el universo; temperatura a la cual la materia no tendría energía interna, el movimiento de las partículas que forman la materia quedaría detenido. El grado Kelvin (K) equivale al centígrado y para pasar de una escala a otra se utiliza:
T ( en K) = t (enºC) + 273 t (en ºC) = T (en K) - 273
|
Escala Farenheit
El grado Farenheit no es igual que el Kelvin o Celsius, ya que Farenheit coloca el 0 a la temperatura de una mezcla de agua, hielo y cloruro amónico (-32ºC) , y el 96 en la temperatura del cuerpo humano (37 ºC) , por ello la conversión entre una escala y otra viene dada por:
| Escalas |
Celsius
|
Kevin
|
Fahrenheit
| |
| Unidad |
ºC
|
K
|
ºF
| |
| Temperaturas de referencia | Punto de fusión del agua |
0
|
273
|
32
|
| Punto de vaporización del agua |
100
|
373
|
212
| |
Equivalencias
|
K=273+ºC
|
ºF=1,8•ºC+32
| ||
En este esquema comparativo puedes ver las escalas más importantes:
4.3. Conversión de valores de temperaturas
La escala Celsius y la escala Kelvin tiene una transformación muy sencilla:
grados K = 273.15 + grados C
En la transformación de grados centígrados a grados Fahrenheit debes tener en cuenta que cada grado centígrado vale 1,8 ºF ( 0 - 100 en la escala centígrada equivale a 32 - 210 en la escala Fahrenheit). Por lo tanto debes multiplicar los grados centígrados por 1,8 que equivale a 9/5 . Como el cero Celsisus corresponde al 32 Fahrenheit debes sumar 32:
grados F = (9/5) * grados C + 32
Para la transformación inversa se despeja y queda:
grados C = ( 5/9) * ( grados F - 32)
ANIMACIONES



5. CALOR
Durante muchos años se creyó que el calor era un componente que impregnaba la materia y que los cuerpo absorbían o desprendían según los casos.
Rumford, taladrando tubos de metal para construir cañones, se dio cuenta de que cuanto más roma estaba la broca más calor se desprendía. ¡El calor se generaba al rozar la broca con el metal! ¡La energía cinética de la broca se transformaba en calor!
El calor es por lo tanto una forma de energía. Es la "energía calorífica". Un inglés llamado J.P. Joule halló su equivalencia con las unidades del trabajo.
El Universo está hecho de materia y energía. La materia está compuesta de átomos y moléculas (que son grupos de átomos) y la energía hace que los átomos y las moléculas estén en constante movimiento: rotando alrededor de si mismas, vibrando o chocando unas con otras. Cuando la materia desaparece (a veces esto ocurre espontáneamente en las sustancias radiactivas) se transforma en energía (E=mc2)
El movimiento de los átomos y moléculas está relacionado con el calor o energía térmica. Al calentar una sustancia aumenta la velocidad de las partículas que la forman.
La cantidad total y absoluta de energía que tiene un cuerpo, que es la que podría teóricamente ceder, es muy difícil de precisar.
Nos referimos al calor como a esa energía que intercambian los cuerpos (energía de tránsito) y que podemos medir fácilmente.
El calor es una energía que fluye de los cuerpos que se encuentran a mayor temperatura a los de menor temperatura. Para que fluya se requiere una diferencia de temperatura. El cuerpo que recibe calor aumenta su temperatura, el que cede calor disminuye su temperatura. Resulta evidente que los dos conceptos, calor y temperatura, están relacionados.
El calor es una energía de tránsito, sólo tiene sentido hablar de variación de calor mientras la energía fluye de un cuerpo a otro.
Es una energía degradada ya que es imposible recuperar toda la energía mecánica que se invirtió en producirlo. Se recupera energía mecánica haciéndolo fluir en las máquinas térmicas del foco caliente al frío y retirando parte de esa energía en forma de energía mecánica (movimiento) pero una parte importante del calor debemos arrojarla al entorno en el foco frío.
Los rendimientos de la máquinas se calculan por la relación de temperaturas entre las que funcionan y es imposible un rendimiento del 100%
R = (T1-T2) / T1
La energía puede presentarse de muy diferentes formas y puede cambiar de una forma a otra.
Pero existen muchas transformaciones de energía.....
- Ya vimos la experiencia en la que por rozamiento la broca transformaba energía cinética en energía calorífica.
- La energía electromagnética (luz del Sol) calienta la Tierra. Esta es la primera fuente de toda la energía que llega a la Tierra y que luego se transforma en otros tipos de energía.
- Los cuerpos emiten energía calorífica en forma de radiación en el infrarrojo.
- Las reacciones química de combustión desprenden calor (exotérmicas), otras lo absorben (endotérmicas).
- La electricidad circulando por una resistencia la calienta.
- Un balón al chocar contra el suelo transforma su energía mecánica en calor al deformarse.
- Nuestros cuerpos transforman la energía química de los alimentos en calor: para vivir necesitamos unas 2.100.000 calorías al día.
- Las reacciones nucleares generan calor al desaparecer la masa.
- Al producir un sonido hacemos vibrar las partículas de aire y esta energía se transmite en el aire: las ondas transportan energía.
Esta cualidad del agua es la responsable del clima benigno (poco oscilante entre el día y la noche) en las proximidades del mar para una misma latitud terrestre.
La capacidad del agua de "encajar" los impactos de calor "sin casi inmutarse" incrementando poco su temperatura se representa mediante una magnitud llamada "calor específico" (Ce) : calor que necesita 1 g de sustancia para aumentar 1 grado su temperatura.
calor específico de un cuerpo viene definida por la cantidad de calorías que son necesarias para que un gramo de masa de dicho cuerpo aumente su temperatura en un grado
En consecuencia, el calor específico del agua es 1 cal /g. grado.
Se llama caloría " la cantidad de calor necesaria para que 1g de agua aumente 1º su temperatura" ( más exactamente para pasar de 14,5 º a 15,5º)
Una vez demostrado que el calor es una forma de energía se halló su equivalencia con otras unidades que surgieron del estudio de la energía mecánica. Hoy se utiliza siempre el S.I. y usamos como unidad de trabajo y de energía el julio (1 caloría = 4,18 Julios ).
Cada sustancia tiene un calor específico característico, casi siempre mucho menor que el del agua.
En consecuencia, el calor específico del agua es 1 cal /g. grado.
Se llama caloría " la cantidad de calor necesaria para que 1g de agua aumente 1º su temperatura" ( más exactamente para pasar de 14,5 º a 15,5º)
Una vez demostrado que el calor es una forma de energía se halló su equivalencia con otras unidades que surgieron del estudio de la energía mecánica. Hoy se utiliza siempre el S.I. y usamos como unidad de trabajo y de energía el julio (1 caloría = 4,18 Julios ).
En el Sistema Internacional el Calor eespecífico (agua) = 4180 J / kg ºK.
Cada sustancia tiene un calor específico característico, casi siempre mucho menor que el del agua.
Pero la cantidad de calor que puede acumular o perder una masa de agua depende, además de su calor específico, de la masa de la sustancia. El producto de la masa por el calor específico se llama "capacidad calorífica".
Cuanta más capacidad calorífica tenga un cuerpo menos incremente su temperatura para un mismo aporte de calor. Es como la capacidad que tiene la sustancia para "encajar" el calor.
El calor necesario para un mismo incremento de temperatura de una cierta sustancia depende de su masa: cuanta más masa, más calor se requiere.
Uniendo todos los factores anteriores obtenemos la fórmula que nos da el calor cedido o absorbido por un cuerpo cuando varía su temperatura:
Q = masa cuerpo · Ce (cuerpo) . ( Tf - Ti)
Para medirlo necesitamos conocer el comportamiento de la sustancia frente al calor, es decir su Ce, su masa y el indicativo de su nivel térmico (su temperatura) antes y después de recibir o perder calor.A veces la sustancia recibe energía (calor) y no incrementa su temperatura. Es lo que ocurre en los cambios de estado. Un caso concreto lo tenemos en la fusión del hielo. Si suministramos calor a una mezcla formada por hielo fundido y hielo sin fundir el calor se emplea en fundir más hielo y la temperatura del agua no se incrementa.
ANIMACIONES
5.2. Formas de transmisión del calor
5.2.1 Conducción
Si se calienta el extremo de una barra metálica al poco tiempo el calor llega al extremo más alejado de la fuente de calor. Este proceso es un ejemplo de la conducción de calor.
En la conducción de calor las partículas más cercanas a la fuente de calor se agitan con más energía que las que están más alejadas. Esta energía se comunica de unas partículas a las más cercanas (por contacto) hasta que la energía se reparte por todo el sólido.
En la conducción el calor se trasmite por interacción entre las partículas que forman las sustancias sin que exista un desplazamiento neto de esas partículas.
Esta forma de transmisión de calor es típica de los sólidos , pero no en todos esta conducción se realiza a la misma velocidad los buenos conductores de calor permite el paso rápido del calor (los metales por ejemplo son buenos conductores térmicos).los malos conductores o aislantes del calor dificultan la transmisión del calor a través de ellos (por ejemplo la madera es un buen aislante térmico o mal conductor del calor).




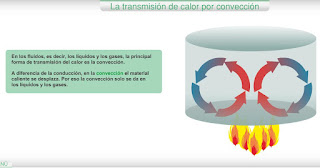
5.2.2. Convección
Cuando se mezcla leche fría con café muy caliente, observamos que ambos líquidos se mezclan hasta quedar a una temperatura tibia. Se ha producido una transferencia de calor desde el café a la leche. Esta transferencia es un ejemplo de transferencia por convección.
En la convección se trasmite el calor por desplazamiento de las partículas que forman los cuerpos.
Esta forma de transferencia del calor es típica de líquidos y gases. Ejemplos son las corrientes de convección que se establecen en el aire atmosférico.



5.2.3. Radiación
Cuando nos acercamos a un cuerpo muy caliente, se nota que llega calor desde él. Lo mismo ocurre con el calor del Sol, que se recibe desde millones de kilómetros, sin que entre él y la Tierra haya ningún medio material que transporte la energía.
En la transmisión por radiación el calor se propaga sin necesitar la ayuda de materia. La energía calorífica se trasmite por ondas electromagnéticas.
Las radiaciones electromagnéticas son ondas que pueden viajar a través de la materia pero también a través del vacío.
Si el cuerpo está a la misma temperatura que su entorno quiere decir que emite la misma cantidad de radiación que absorbe.
Si el cuerpo está a mayor temperatura que el entorno, entonces emite más radiación que la que absorbe.
Si el cuerpo está a menos temperatura entonces absorbe más radiación que la que emite.
La cantidad de energía por radiación que absorbe o emite un cuerpo depende de la temperatura y la superficie.
5.3. Energía interna
La energía interna se define como la energía asociada con el movimiento aleatorio y desordenado de las moléculas. Está en una escala separada de la energía macroscópica ordenada, que se asocia con los objetos en movimiento. Se refiere a la energía microscópica invisible de la escala atómica y molecular. Por ejemplo, un vaso de agua a temperatura ambiente sobre una mesa, no tiene energía aparente, ya sea potencial o cinética. Pero en escala microscópica, es un hervidero de moléculas de alta velocidad que viajan a cientos de metros por segundo.
La u es el símbolo común mas usado para representar la energía interna.
Las cantidades relacionadas con la energía, que son particularmente útiles en la termodinámica química son la entalpía, la energia libre de Helmholtz, y la energía libre de Gibbs.
Si viajas en tren o atraviesas un puente en coche, notarás que a veces la vía o la carretera tienen pequeñas interrupciones que aprecias como un ligero salto: son separaciones entre dos tramos que permiten el aumento de tamaño que se produce en épocas de calor.
La explicación se basa en la teoría cinética: las partículas que forman los sólidos y los líquidos tienen un movimiento de vibración que aumenta al incrementarse su temperatura; esto hace que cada vez estén más separadas y, por tanto, aumente el tamaño del cuerpo.
La dilatación es el fenómeno por el cual casi todas las sustancias aumentan su volumen al calentarlas(disminuye su densidad). El efecto contrario se denomina contracción.
6.1. Dilatación de los sólidos
Cuando un cuerpo se dilata, lo hace en sus tres dimensiones, pero si una de ellas es mucho mayor que las otras se habla de esa dilatación. Existen pues, dilatación lineal, superficial y cúbica. La variación del tamaño dependerá del tamaño inicial, de la variación de temperatura que experimenta y del tipo de material que se trate. Según se trate de una dilatación lineal, superficial o cúbica, se utilizan las siguientes expresiones:
Δl = l0 α ΔT
ΔS = S0 β ΔT
ΔV = V0 γ ΔT
α, β y γ son los coeficientes de dilatación lineal, superficial y cúbica, respectivamente, y dependen del material que forme el cuerpo. Su valor significa el alargamiento producido en cada metro de sólido al calentarlo 1 ºC o 1 K.En la siguiente tabla tienes los coeficientes de dilatación de materiales usuales.
Esta misma solución se adopta en los puentes. Cuando vas en coche y pasas por un puente, te habrás dado cuenta de que hay unos pequeños baches que cruzan la calzada. Ahí están "escondidas" las juntas de dilatación.
Lo mismo sucede en las pistas deportivas, con juntas de dilatación entre las placas de hormigón.
6.2. Dilatación de los líquidos
En general, los líquidos se dilatan más que los sólidos cuando se someten a un aumento de temperatura. Esto se debe a que las partículas que forman un líquido están menos unidas entre sí que las de un sólido, se separan con más facilidad y por eso su coeficiente de dilatación es mayor. No obstante, esta dilatación es más difícil de medir, ya que los líquidos deben estar contenidos en el interior de un recipiente que también se dilata.
La dilatación lineal del mercurio se ha aprovechado durante mucho tiempo para construir termómetros. Actualmente está prohibido utilizar mercurio, dada su gran toxicidad y capacidad contaminante del medio ambiente, razón por la que se construyen de alcohol o, mejor aún, digitales.
6.2. Dilatación de los gases
El estado gaseoso es el más sencillo de estudiar, ya que las partículas de los gases prácticamente no interaccionan entre ellas. Las leyes de los gases se conocen desde hace siglos: si se calienta hasta una temperatura Tf un recipiente de volumen Vi variable que contiene gas a una temperatura Ti, el volumen final Vfviene dado por la relación:
7. CALOR Y TRABAJO
La conversión inversa (conversión de energía mecánica en calor) es aún más frecuente. Cada vez que se realiza un trabajo mecánico, una parte se transforma en energía térmica: es la energía que se pierde por rozamiento. Así, aunque en el proceso la energía se conserva, una parte se transfiere en forma de calor, que hace aumentar la temperatura del sistema.
Esa energía perdida se degrada, pues ya no se puede aprovechar. Sucede esto, por ejemplo, cuando golpeas repetidamente una pieza metálica con un martillo y observas que acaba por calentarse, o cuando tiras de un cuerpo con una cuerda y tus manos se calientan con el roce: la energía total es la misma, pero es mucho más difícil aprovecharla.
Equivalente mecánico del calor
En 1845 el físico británico James Prescott Joule realizó un experimento para determinar la equivalencia entre el calor y el trabajo. Con un dispositivo similar al de la simulación, Joule midió el aumento de temperatura del agua (T2-T1) cuando las pesas descendían una determinada altura.
El calor que recibe el agua es: Q = m . ce (T2-T1)
El trabajo que realizan los cuerpos es W = m g h
Como se trabaja en un sistema aislado, todo el trabajo de las pesas se transforma en el calor que recibe el agua (W = Q). Joule encontró que siempre que el agua recibía 1 caloría de calor, las pesas habían realizado un trabajo de 4,18 J.



6. LEYES DE LA TERMODINÁMICA
Se considera que las Leyes de la Termodinámica son las leyes de «más categoría» de toda la física, y por ende, de toda la ciencia. Son las más comprobadas de toda la ciencia, y se consideran auténticos pilares de la física. Si algún día se demostraran equivocadas, toda nuestra ciencia moderna se tambalearía.
6.1. Primera Ley
La Primera Ley de la Termodinámica, en realidad sí que es muy conocida por el público en general, y posiblemente sea la ley física más conocida por todo el mundo. Se trata de la ley de conservación de la energía, que podemos enunciar así: «La energía ni se crea ni se destruye, sólo se transforma».
Su enunciación formal es diferente, pero la idea que subyace es esa. En cualquier proceso que podemos imaginar, la energía en juego es siempre la misma. Si ganamos energía, debe ser a costa de algo o alguien, y si la perdemos, debe ir a algún sitio. No podemos obtener energía de la nada, o como dice el dicho popular, «de donde no hay, no se puede sacar».
Durante siglos, inventores de todo tipo han intentado encontrar lo que se denomina «máquina de movimiento perpetuo de primera especie»: una máquina que produce más energía de la que consume. Pero como podemos ver, eso es imposible. La Primera Ley nos lo impide.
En el juego de la termodinámica, sencillamente, no puedes ganar.
6.2. Segunda Ley
La Segunda Ley de la Termodinámica es algo menos conocida, y más «críptica». Puede que a alguno le suene como la ley de «eso raro de la entropía». En efecto, la enunciación más común de la Segunda Ley nos dice que la entropía de un sistema (cerrado y que no esté en equilibrio), tiende a incrementarse con el tiempo, hasta alcanzar el equilibrio.
¿Y eso qué significa? ¿Qué es eso de la entropía? Bueno, podemos definir la entropía como la «energía no aprovechable» para realizar un trabajo. Es decir, una energía que está ahí, pero que no podemos utilizar. ¿Y cómo es eso? Veamos, cualquier objeto del universo, por el mero hecho de estar a una temperatura superior al cero absoluto (0 K), tiene una energía interna, que denominamos calor (en realidad, siendo puristas, el calor es la transferencia de esa energía interna, pero de momento no necesitamos ser tan precisos). Pero para aprovechar ese calor, el objeto debe poder transferirlo a otro. Y para que esto ocurra, ese segundo objeto debe tener menor temperatura.
Esto es muy fácil de entender si pensamos en lo siguiente: imaginemos que tenemos una jarra de leche caliente, y otra de leche fría. Si mezclamos ambos líquidos, la leche fría se calentará, y la caliente se enfriará, hasta que tengamos toda la leche a la misma temperatura. Sin embargo, si volvemos a separar la leche en dos jarras, nunca, jamás de los jamases, una se enfriará a costa de la otra (que se calentaría), de forma natural. Al mezclar la leche de las dos jarras, hemos realizado un proceso irreversible. Si queremos volver a tener una diferencia de temperatura entre las jarras, necesitaremos una fuente de energía externa, para «bombear» el calor de una a la otra.
Así que podemos pensar que la Segunda Ley nos dice que el calor fluye de forma natural de los cuerpos de más temperatura, a los de menos. Y si queremos invertir ese proceso, necesitamos aplicar energía. Por eso los aires acondicionados y los frigoríficos consumen energía, a pesar de extraer calor (energía) de otros objetos, ya que ese calor extraído no es aprovechable.
Una de las consecuencias de esta ley (y así la definió Lord Kelvin), es que no podemos transformar el 100% del calor en energía aprovechable. O lo que es lo mismo, no existe ningún proceso de transformación de energía, 100% eficiente. En todo proceso, perderemos algo de energía, en forma de calor, que se utilizará para elevar la temperatura de algún componente de nuestra máquina, o de su entorno, y no podremos aprovechar.
Durante siglos, los inventores han intentado también encontrar una forma de transformar la energía, con una eficiencia del 100%. Pero eso sería una «máquina de movimiento perpetuo de segunda especie», algo menos ambiciosa que la de primera especie, pero igualmente imposible, ya que la Segunda Ley nos lo impide.
En el juego de la termodinámica, tampoco puedes empatar.
6.3. Tercera Ley
La Tercera Ley de la Termodinámica, sí que es una «gran desconocida» para público en general. Y sin embargo también es fundamental, ya que nos permite definir escalas absolutas de temperatura. Básicamente nos dice que es imposible alcanzar la temperatura de 0 K (cero absoluto), en un número finito de procesos, lo que en la práctica significa que es imposible alcanzar dicha temperatura.
Eso quiere decir que todos los objetos del universo tienen una temperatura superior a 0 K, por lo que todos los objetos del universo, tienen algo de calor, aunque sea muy poco. Y por tanto, ninguno escapa de la Termodinámica.
En el juego de la termodinámica, ni si quiera puedes abandonar.
6.4. Ley cero
Existe una Ley Cero de la Termodinámica. Este curioso nombre es debido a que es mucho más básica que las demás, pero se enunció con bastante posterioridad (ya teníamos una Primera Ley). Dice que dos sistemas que estén en equilibrio termodinámico con un tercero, entonces están en equilibrio entre sí. Puede parecer una perogrullada, pero es necesaria enunciarla formalmente.
7. CUESTIONES

















No hay comentarios:
Publicar un comentario