ÍNDICE
|
15. Modelo atómico de Bohr
16. Orígenes de la mecánica cuántica
1. Hipótesis de De Broglie
2. Principio de Heisemberg
4. Ecuación de Schrodinger
17. Los números cuánticos
1. Número cuántico principal
2. Número cuántico secundario
3. Número cuántico magnético
4. Número cuántico de spin
18. Configuración electrónica
19. Evolución histórica del Sistema Periódico
20. Estructura electrónica y Sistema Periódico
1. Propiedades eléctricas
2. Energía de ionización
3. Afinidad electrónica
4. Electronegatividad
5. Radio atómico e iónico
6. Estados de oxidación
21. Resumen
22. Prácticas
23. Cuestiones
24. Otros contenidos
25. Vídeos
|
1. ESQUEMAS








TablaPeriódica
Tabla Periodica_Explicacion Propiedades
Átomos
Estructura de la materia
3. CONTENIDOS ANIMADOS






Clasificación de los átomos
4. INTRODUCCIÓN
Desde la aparición de la teoría atómica de Dalton, han sido muchas las experiencias que han dado la evidencia de que los átomos no eran indivisibles, sino que estaban formados por partículas subatómicas; y estos descubrimientos dieron lugar a la elaboración de modelos teóricos a cerca de la estructura del átomo.
4.1. Teoría atómica de Dalton
Fue establecida por el científico inglés John Dalton en 1808. A pesar de que en su época existían escasos avances técnicos, fue uno de los primeros científicos en afirmar (sin poder demostrarlo) que cualquier objeto debía estar formado por la unión de muchísimas partículas. Su teoría se basa en las siguientes ideas (o postulados):
ANIMACIONES

5. EL ELECTRÓN
Si en un tubo de rayos catódicos introducimos un gas a muy baja presión y le aplicamos un alto voltaje entre los electrodos, se observa la formación de unos rayos que van del cátodo al ánodo (rayos catódicos).
Se trataba de partículas materiales ya que si colocábamos en su trayectoria un molinillo de aspas muy finas, éstas giraban al chocar sobre ellas los rayos catódicos y además tenían que ser de carga negativa puesto que se dirigían al polo positivo y podías ser desviados por la acción de campos magnéticos.
Si en el tubo se aplicaba el vacío el fenómeno también ocurría. A estas partículas se las llamó electrones.


Sea cual fuese el material del cátodo o el gas del tubo, las partículas emitidas eran siempre las mismas, lo que llevó a la idea de que los electrones eran un constituyente fundamental de todos los átomos.
Años más tarde, en 1909, Millikan, mediante un famoso experimento a través de campos eléctricos y magnéticos, pudo determinar que:

6. MODELO ATÓMICO DE THOMSON
El descubrimiento de los electrones y de los rayos catódicos supuso toda una revolución ya que ponía en evidencia que la teoría atómica de Dalton podía tener fallos: los átomos no eran indivisibles sino que estaban formados por partículas más pequeñas. Pero, todo ésto planteó nuevos interrogantes: ¿cómo era el átomo en su interior?, ¿cuál era su estructura?
4.1. Teoría atómica de Dalton
Fue establecida por el científico inglés John Dalton en 1808. A pesar de que en su época existían escasos avances técnicos, fue uno de los primeros científicos en afirmar (sin poder demostrarlo) que cualquier objeto debía estar formado por la unión de muchísimas partículas. Su teoría se basa en las siguientes ideas (o postulados):
- Cualquier objeto está formado por miles y miles de partículas indivisibles y muy pequeñas llamadas átomos.
- Los átomos del mismo elemento químico son iguales entre sí, es decir, tienen la misma masa y las mismas propiedades. Dalton asignó a cada átomo un símbolo especial; en la tabla de la derecha aparecen algunos de ellos.
- Los átomos de diferentes elementos químicos son distintos entre sí, es decir, tienen distintas masas y propiedades.
- Los compuestos químicos resultan de la unión más sencilla posible entre átomos de diferentes elementos.
ANIMACIONES

5. EL ELECTRÓN
Si en un tubo de rayos catódicos introducimos un gas a muy baja presión y le aplicamos un alto voltaje entre los electrodos, se observa la formación de unos rayos que van del cátodo al ánodo (rayos catódicos).
Se trataba de partículas materiales ya que si colocábamos en su trayectoria un molinillo de aspas muy finas, éstas giraban al chocar sobre ellas los rayos catódicos y además tenían que ser de carga negativa puesto que se dirigían al polo positivo y podías ser desviados por la acción de campos magnéticos.

Sea cual fuese el material del cátodo o el gas del tubo, las partículas emitidas eran siempre las mismas, lo que llevó a la idea de que los electrones eran un constituyente fundamental de todos los átomos.
Años más tarde, en 1909, Millikan, mediante un famoso experimento a través de campos eléctricos y magnéticos, pudo determinar que:

6. MODELO ATÓMICO DE THOMSON
El descubrimiento de los electrones y de los rayos catódicos supuso toda una revolución ya que ponía en evidencia que la teoría atómica de Dalton podía tener fallos: los átomos no eran indivisibles sino que estaban formados por partículas más pequeñas. Pero, todo ésto planteó nuevos interrogantes: ¿cómo era el átomo en su interior?, ¿cuál era su estructura?
La primera hipótesis la emitió Joseph John Thomson en 1904 al suponer que:
"El átomo está constituido por una esfera material, pero de carga eléctrica positiva, dentro de la cual se encontraban embebidos los electrones necesarios para neutralizar dicha carga y distribuidos en una ordenación que depende del elemento correspondiente".
Este modelo explicaba el fenómeno de los rayos catódicos ya que el átomo así constituido desprendía electrones al provocar una diferencia de potencial elevada entre los electrodos del tubo de rayos catódicos.
7. EL PROTÓN
Si la materia es eléctricamente neutra y está compuesta por partículas de carga negativa, (electrones), es de esperar que también existan partículas de carga positiva.
La primera evidencia experimental de la existencia de dichas partículas fue dada por Goldstein en 1886 usando también un tubo de descarga de gases en el que se habían practicado unos orificios en el cátodo (polo negativo).
Al mismo tiempo que se producen los rayos catódicos, se producían otros rayos (rayos canales), algunos de los cuales atravesaban los orificios del cátodo para chocar con las paredes del tubo.

 Más tarde se demostró que dichas partículas estaban cargadas positivamente y que su relación c/m dependía del gas utilizado en las experiencias.
Más tarde se demostró que dichas partículas estaban cargadas positivamente y que su relación c/m dependía del gas utilizado en las experiencias.
La explicación de todos estos fenómenos, era la siguiente: al aplicar un alto voltaje al tubo se desprenden electrones del material que forma el cátodo dirigiéndose hacia el ánodo (polo positivo). Algunos de los electrones chocaban por el camino con las partículas del gas, de las que se desprenden a su vez electrones, quedando las partículas del gas cargadas positivamente y dirigiéndose hacia el cátodo (rayos canales).
Se demostró que la más pequeña de estas partículas tenía aproximadamente la misma masa que 1 u.m.a. y una carga positiva de igual magnitud que la del electrón. A esta partícula se la llamó protón.

8. EL MODELO DE RUTHERFORD
A principios del siglo XX ya se sabía que el átomo estaba constituido por dos partículas: el electrón (e‑) y el protón (p+).
En 1906 Rutherford llevó a cabo un experimento para comprobar la veracidad del modelo de Thomson, para ello, bombardeó con partículas alfa, "α", (núcleos de átomos de He, es decir, partículas con dos cargas positivas), una lámina de oro de unos 500 Aº de espesor.
Según el modelo de Thomson, al tener el átomo la carga positiva uniformemente repartida por todo el volumen del átomo y ser de densidad muy baja, sólo debería ejercer débiles fuerzas eléctricas de repulsión sobre las partículas alfa y por lo tanto deberían pasar todas sin sufrir modificaciones significativas de su trayectoria, sin embargo, Rutherford se encontró con un hecho sorprendente:
La mayoría de las partículas, efectivamente, atravesaban la lámina de oro sin desviarse, pero lo sorprendente del experimento era que:
unas pocas se desviaban de su trayectoria y muy pocas incluso rebotaban (una de cada 8000 se desviaba más de 90º con respecto a su trayectoria inicial). El mismo Rutherford describe su asombro ante tal resultado con estas palabras: "... Esto era lo más increíble que me había ocurrido en mi vida. Tan increíble como si dispararas un proyectil de 15 pulgadas, contra una hoja de papel de seda y rebotara de vuelta hacia ti”
"El átomo está constituido por una esfera material, pero de carga eléctrica positiva, dentro de la cual se encontraban embebidos los electrones necesarios para neutralizar dicha carga y distribuidos en una ordenación que depende del elemento correspondiente".
Este modelo explicaba el fenómeno de los rayos catódicos ya que el átomo así constituido desprendía electrones al provocar una diferencia de potencial elevada entre los electrodos del tubo de rayos catódicos.
7. EL PROTÓN
Si la materia es eléctricamente neutra y está compuesta por partículas de carga negativa, (electrones), es de esperar que también existan partículas de carga positiva.
La primera evidencia experimental de la existencia de dichas partículas fue dada por Goldstein en 1886 usando también un tubo de descarga de gases en el que se habían practicado unos orificios en el cátodo (polo negativo).
Al mismo tiempo que se producen los rayos catódicos, se producían otros rayos (rayos canales), algunos de los cuales atravesaban los orificios del cátodo para chocar con las paredes del tubo.
La explicación de todos estos fenómenos, era la siguiente: al aplicar un alto voltaje al tubo se desprenden electrones del material que forma el cátodo dirigiéndose hacia el ánodo (polo positivo). Algunos de los electrones chocaban por el camino con las partículas del gas, de las que se desprenden a su vez electrones, quedando las partículas del gas cargadas positivamente y dirigiéndose hacia el cátodo (rayos canales).
Se demostró que la más pequeña de estas partículas tenía aproximadamente la misma masa que 1 u.m.a. y una carga positiva de igual magnitud que la del electrón. A esta partícula se la llamó protón.

A principios del siglo XX ya se sabía que el átomo estaba constituido por dos partículas: el electrón (e‑) y el protón (p+).
En 1906 Rutherford llevó a cabo un experimento para comprobar la veracidad del modelo de Thomson, para ello, bombardeó con partículas alfa, "α", (núcleos de átomos de He, es decir, partículas con dos cargas positivas), una lámina de oro de unos 500 Aº de espesor.
Según el modelo de Thomson, al tener el átomo la carga positiva uniformemente repartida por todo el volumen del átomo y ser de densidad muy baja, sólo debería ejercer débiles fuerzas eléctricas de repulsión sobre las partículas alfa y por lo tanto deberían pasar todas sin sufrir modificaciones significativas de su trayectoria, sin embargo, Rutherford se encontró con un hecho sorprendente:
La mayoría de las partículas, efectivamente, atravesaban la lámina de oro sin desviarse, pero lo sorprendente del experimento era que:
unas pocas se desviaban de su trayectoria y muy pocas incluso rebotaban (una de cada 8000 se desviaba más de 90º con respecto a su trayectoria inicial). El mismo Rutherford describe su asombro ante tal resultado con estas palabras: "... Esto era lo más increíble que me había ocurrido en mi vida. Tan increíble como si dispararas un proyectil de 15 pulgadas, contra una hoja de papel de seda y rebotara de vuelta hacia ti”

Para explicar este fenómeno, Rutherford, en 1911, emitió una serie de hipótesis acerca de la estructura interna del átomo:
La mayoría del espacio de los átomos está libre de partículas.

Los átomos contienen en el centro un núcleo positivo constituido por protones y donde está concentrada casi toda la masa del átomo.
Los e‑ forman una corteza extranuclear y deberán moverse continuamente para no precipitarse sobre el núcleo debido a la atracción electrostática.
El tamaño del núcleo es de diez a cien mil veces menor que el tamaño del átomo, (existe un gran vacío).
ANIMACIONES








9. EL NEUTRÓN
Ya en 1920, el mismo Rutherford, supuso que el núcleo de los átomos estaba constituido por protones y además parejas protón ‑ electrón, que denominó neutrones. Sin embargo, fue en 1932 cuando, al poder determinar con mayor precisión la relación carga/masa de algunos iones, James Chadwick pudo demostrar la existencia de un tercer componente del átomo, el neutrón, que no poseía carga eléctrica y tenía una masa similar a la del protón.
Partícula
|
Masa en Kg
|
Masa en umas
|
Carga en C
| Carga relativa |
| Electrón | 9,108.10-31 | 0,00055 | - 1,602.10-19 | -1 |
| Protón | 1,672.10-27 | 1,00759 | + 1,602.10-19 | +1 |
| Neutrón | 1,675.10-27 | 1,00898 | 0 | 0 |
Aunque nosotros trabajaremos con estas tres partículas, electrones, protones y neutrones, debemos saber que la subdivisión continúa. En 1964 Gell-Mann y Zweig propusieron la teoría de los Quarks. Esta considera que en el átomo existen dos docenas de partículas, en su mayoría inestables de forma aislada y algunas de ellas incluso con carga fraccionaria, que pueden agruparse en dos familias: los leptones y los guarks.
Son de un interés especial las llamadas antipartículas: el positrón, el antiprotón y el antineutrón que son partículas de idéntica masa que sus homónimas pero con carga de distinto signo.
Las antipartículas son estables de forma aislada, pero cuando se encuentran con sus equivalentes, se aniquilan mutuamente transformándose en energía por completo. Hay teorías que suponen la existencia de galaxias enteras formadas por antimateria. Puedes encontrar más información en la siguiente pagina web:
10. EL NÚCLEO ATÓMICO
Hoy se sabe que el núcleo de cualquier átomo está constituido por protones y neutrones. A partir de ellos, se define:
Z: número atómico = nº protones del núcleo = nº electrones si el átomo está neutro.
A: número másico = nº protones + nº neutrones = partículas que hay en el núcleo.
Si dos átomos poseen el mismo número atómico Z, pertenecen al mismo elemento. Es decir, que un elemento queda perfectamente definido dando su número atómico; sin embargo, para dar más información, también se suele dar el número másico, representándose de la siguiente manera:

por ejemplo:
13C  6 protones, 6 electrones y 7 neutrones
6 protones, 6 electrones y 7 neutrones
 6 protones, 6 electrones y 7 neutrones
6 protones, 6 electrones y 7 neutrones
14C  6 protones, 6 electrones y 8 neutrones
6 protones, 6 electrones y 8 neutrones
 6 protones, 6 electrones y 8 neutrones
6 protones, 6 electrones y 8 neutrones
14N  7 protones, 7 electrones y 7 neutrones
7 protones, 7 electrones y 7 neutrones
 7 protones, 7 electrones y 7 neutrones
7 protones, 7 electrones y 7 neutrones
con frecuencia, como vemos, el número atómico se omite, ya que al dar el símbolo del elemento queda perfectamente definido.
10.1. Concepto y tipos de isótopos
Los isótopos son átomos de un mismo elemento, (por tanto, de igual número atómico Z) con distinto número másico A, es decir, poseen diferente número de neutrones en su núcleo.
Veamos una serie de ejemplos
Para el carbono Z=6. Es decir, todos los átomos de carbono tienen 6 protones y 6 electrones.
El carbono tiene dos isótopos: uno con A=12, con 6 neutrones y otro con número másico 13 (7 neutrones), que se representan como:
El carbono con número másico 12 es el más común (~99% de todo el carbono). Al otro isótopo se le denomina carbono-13.
El hidrógeno presenta tres isótopos, y en este caso particular cada uno tiene un nombre diferente
La forma más común es el hidrógeno, que es el único átomo que no tiene neutrones en su núcleo.
Otro ejemplo son los dos isótopos más comunes del uranio:
los cuales se denominan uranio-235 y uranio-238.
En general las propiedades químicas de un elemento están determinadas fundamentalmente por los protones y electrones de sus átomos y en condiciones normales los neutrones no participan en los cambios químicos. Por ello los isótopos de un elemento tendrán un comportamiento químico similar, formarán el mismo tipo de compuestos y reaccionarán de manera semejante.
10.2. Masa atómica
La masa atómica relativa de un elemento, es la masa en gramos de 6.02 ·1023 átomos (número de Avogadro, NA) de ese elemento, la masa relativa de los elementos de la tabla periódica desde el 1 hasta el 105 esta situada en la parte inferior de los símbolos de dichos elementos. El átomo de carbono, con 6 protones y 6 neutrones, es el átomo de carbono 12 y es la masa de referencia para las masas atómicas. Una unidad de masa atómica (u.m.a), se define exactamente como 1/12 de la masa de un átomo de carbono que tiene una masa 12 u.m.a. una masa atómica relativa molar de carbono 12 tiene una masa de 12 g en esta escala. Un mol gramo (abreviado, mol) de un elemento se define como el numero en gramos de ese elemento igual al número que expresa su masa relativa molar. Así, por ejemplo, un mol gramo de aluminio tiene una masa de 26.98 g y contiene 6.023 ·1023 átomos.
Veamos unos ejercicios de aplicación:
La plata natural está constituida por una mezcla de dos isótopos de números másicos 107 y 109. Sabiendo que abundancia isotópica es la siguiente: 107Ag =56% y 109Ag =44%. Deducir el peso atómico de la plata natural.
Determinar la masa atómica del galio, sabiendo que existen dos isótopos 69Ga y 71Ga, cuya abundancia relativa es, respectivamente, 60,2% y 39,8%. Indica la composición de los núcleos de ambos isótopos sabiendo que el número atómico del galio es 31.
Masa atómica = 69 · 0,602 + 71 · 0,398 = 69,7 u
Núcleo del 6931Ga: 31 protones y 38 neutrones (69 - 31)
Núcleo del 7131Ga: 31 protones y 40 neutrones (71 - 31).
10.3. Tipos de iones
Lo más habitual es que los átomos sean neutros; sin embargo, en algunas ocasiones pueden adquirir carga eléctrica. A un átomo con carga eléctrica se le llama ión. Existen 2 tipos de iones:
 Se trata de un átomo de sodio ; contiene 11 protones, 12 neutrones y 11 electrones. El catión Na+ tendrá una carga eléctrica positiva y por tanto un electrón menos (10 electrones)
Se trata de un átomo de sodio ; contiene 11 protones, 12 neutrones y 11 electrones. El catión Na+ tendrá una carga eléctrica positiva y por tanto un electrón menos (10 electrones)
se trata de un átomo de cloro ; contiene 17 protones, 18 neutrones y 17 electrones. El anión CL- tendrá una carga eléctrica negativa (anión) y tendrá 18 electrones
Lo más habitual es que los átomos sean neutros; sin embargo, en algunas ocasiones pueden adquirir carga eléctrica. A un átomo con carga eléctrica se le llama ión. Existen 2 tipos de iones:
- Catión: es un átomo que tiene carga eléctrica positiva, lo cual significa que ha perdido uno o varios electrones de su capa más externa.
- Anión: es un átomo que tiene carga eléctrica negativa, lo cual significa que ha ganado uno o varios electrones procedentes de otro átomo y los ha incorporado a su capa más externa.
se trata de un átomo de cloro ; contiene 17 protones, 18 neutrones y 17 electrones. El anión CL- tendrá una carga eléctrica negativa (anión) y tendrá 18 electrones





11. LA RADIACTIVIDAD
Becquerel en 1896 descubrió, de forma casual, que ciertas sales de Uranio emitían espontáneamente radiaciones.
Mediante campos magnéticos, se vio que había tres tipos de radiaciones:
- α (alfa): Se trata de partículas positivas que hoy se sabe que son núcleos de átomos de He. Poseen poca energía y no pueden atravesar una simple hoja de papel. Rutherford utilizó estas partículas α en su experimento, procedentes de la desintegración radiactiva del Polonio.

- β (Beta): Son partículas, cargadas negativamente, de propiedades similares a los rayos catódicos. Son, por tanto, electrones. Poseen una energía media y se detienen con una plancha de aluminio de un milímetro.
- γ (Gamma): No tiene carga ni masa. Es energía pura similar a la luz pero de longitud de onda más pequeña. Para detenerla necesitamos una capa de plomo de unos 22 cm de ancha.
La radiactividad natural es debida a la ruptura espontánea de los núcleos. Una indicación de la estabilidad de estos núcleos, es la relación neutrón/protón (N/P). Para los 20 primeros elementos, la relación es aproximadamente 1 y a partir de masa atómica 40, los núcleos se van enriqueciendo de neutrones para neutralizar la repulsión de los protones (por ejemplo, el isótopo 238 del Uranio tiene 92 protones y 146 neutrones).
A pesar de ésto, los núcleos más abundantes poseen una relación N/P inferior a 1'2 y no se hallan núcleos estables con N/P superior a 1'6. Sin embargo, a partir del número atómico 83, la repulsión de los protones es tan grande, que neutrones adicionales ya no pueden estabilizar el núcleo, y estos núcleos muy pesados se descomponen espontáneamente ya sea con radiación α, ß y/o γ.

El químico inglés Frederick Soddy formuló las siguientes leyes que rigen los procesos de desintegración radiactiva de los núcleos atómicos:
- Cuando un núcleo emite una partícula α, su número másico disminuye en 4 unidades y su número atómico en 2.
- Cuando un núcleo emite una partícula ß, su número másico no se modifica y su número atómico aumenta en una unidad.
- Cuando un núcleo emite una partícula γ, no varía ni su número másico ni su número atómico, sólo pierde cierta cantidad de energía (que debe ser múltiplo de un cuánto de energía).
La estructura de los núcleos puede perturbarse artificialmente bombardeándolos con neutrones u otras partículas y se producen entonces núcleos inestables que se descomponen espontáneamente emitiendo radiaciones α, ß y γ, es la llamada radiación artificial. Así se han obtenido isótopos radiactivos de casi todos los elementos. Algunos de ellos tienen aplicaciones de interés científico, por ejemplo:
- Seguir la marcha de una molécula "marcada" en una determinada reacción química.
- Calcular la edad de ciertos materiales orgánicos, (C14)
- Prevenir y curar determinados tipos de enfermedades.
- Conservación de alimentos.
- Combatir determinadas plagas de insectos.
- Obtención de especies vegetales de mayor rendimiento.
12. NATURALEZA DE LA LUZ
Si tiramos una piedra en una piscina donde está flotando un objeto, observamos la superficie del agua subiendo y bajando, y como esta perturbación se va propagando de forma periódica, es decir, a intervalos regulares. Sin embargo, el flotador no se desplaza. Podemos definir una onda como: "La propagación de una perturbación vibracional en la cual se transmite energía pero no materia".
En los siglos XVIII y XIX, se apuntaba hacia la idea de que la luz poseía una naturaleza ondulatoria, es decir se podía representar mediante la ecuación de una onda que se caracteriza por tener una serie de parámetros como:

λ ‑ Longitud de onda: Distancia entre dos máximos consecutivos, (se miden en Aº debido a que dichas distancias son muy pequeñas).
T ‑ Período: tiempo en el que la onda recorre un espacio igual a la longitud de onda. Se mide en segundos.
 ‑ Frecuencia: Es el número de longitudes de onda que pasan por un determinado punto en un segundo. Se mide en Hz (hertz o sg‑1 ). Evidentemente es la inversa del período.
‑ Frecuencia: Es el número de longitudes de onda que pasan por un determinado punto en un segundo. Se mide en Hz (hertz o sg‑1 ). Evidentemente es la inversa del período.
 - Número de onda: Es el número de longitudes de onda que hay en un centímetro, (se mide en cm‑1) y es la inversa de la longitud de onda.
- Número de onda: Es el número de longitudes de onda que hay en un centímetro, (se mide en cm‑1) y es la inversa de la longitud de onda.
Estos enunciados, para el caso de la luz, se pueden expresar matemáticamente de la siguiente manera: la luz por propagarse con M.R.U. cumple la ecuación: v = e/t, y como v = c = 3.108 m/s, y e = λ para t = T, se puede poner que:

es decir:

A principios del siglo XX, Planck y Einstein encontraron que la teoría ondulatoria de la luz no explicaba ciertos hechos experimentales. Por ejemplo, cuando se irradia luz sobre la superficie de ciertos metales, estos emiten electrones. Este hecho no sería extraño si se pensase que la luz como fuente de energía interactúa con la materia arrancando electrones. Por lo tanto, sería de esperar que si se aumentase la intensidad de la luz, los electrones saliesen con más velocidad, sin embargo, lo que ocurre, es que ha medida que aumenta la intensidad de la luz, el número de electrones que salen aumenta, pero todos ellos salen con la misma velocidad y para conseguir que aumente la velocidad de salida de los electrones hay que aumentar la frecuencia de la luz suministrada.
Este fenómeno fue explicado por Planck en 1900 imaginando que la luz está compuesta por paquetes de ondas llamados cuantos o fotones, es decir, que la luz posee una naturaleza corpuscular. Cada fotón posee una determinada energía que sólo depende de su frecuencia:

donde“u”es la frecuencia de la luz y “h” la llamada constante de Planck cuyo valor es de 6'67.10-34 J.s. A mayor frecuencia mayor energía de la luz incidente y como la frecuencia es inversamente proporcional a la longitud de onda, a menor longitud de onda, mayor energía. En el siguiente gráfico se muestra desde las ondas menos energéticas, que son las ondas de radio hasta las más energéticas que son los rayos γ:
Para liberar un electrón hace falta una energía mínima h..υo, donde υo es la frecuencia umbral y por debajo de ella no se arrancan electrones. A medida que la frecuencia aumenta, la energía es mayor y por tanto la velocidad de salida de los e‑ aumenta. Sin embargo, si aumenta la intensidad de la luz se aumenta el número de fotones, pero no la energía de éstos, por lo tanto saldrán más e- pero todos con la misma velocidad.
Hay ciertos fenómenos de la luz que no se pueden explicar por la teoría corpuscular de la luz y sólo son explicables atendiendo a la teoría ondulatoria, por eso se habla de la naturaleza dual de la luz (onda y corpúsculo).
Se ha observado que cuando la luz interactúa con los átomos, éstos absorben radiación electromagnética incluso por debajo de la frecuencia umbral, sin embargo, cada átomo absorbe únicamente luz de determinadas frecuencias. Hay aparatos que registran estas frecuencias o longitudes de onda de la radiación absorbida, denominados espectroscopios.

13. ESPECTROS DE ÁTOMOS
Un espectro puede definirse como el análisis de las distintas longitudes de onda emitidas por un foco luminoso. Todo rayo de luz de una determinada longitud de onda, tiene como imagen en el espectro una y sólo una raya de la misma longitud de onda y frecuencia.


13.1. Espectro de emisión:
Cuando los átomos de un determinado elemento se calientan a una cierta temperatura mediante la llama o el arco eléctrico, éstos se excitan y emiten luz de unas determinadas longitudes de onda que pueden separarse por métodos físicos (prismas), e impresionan una placa fotográfica llamada espectro de emisión.
La siguiente representación corresponde al espectro de emisión del átomo de hidrógeno:

este es un esquema de la imagen del espectro de emisión de un átomo de sodio:


La siguiente representación corresponde al espectro de emisión del átomo de hidrógeno:

este es un esquema de la imagen del espectro de emisión de un átomo de sodio:

ANIMACIONES
Emisión de energía de un electrón
13.2. Espectro de absorción:
Se consigue al hacer pasar una luz blanca (que contiene todos los colores o frecuencias) a través de la muestra gaseosa, la cual absorbe parte de dicha energía. La luz que sale de la muestra (no absorbida) se descompone por medio de un prisma y contendrá todas las frecuencias menos las que haya absorbido la muestra, y se estudiarán las ausencias, es decir, líneas que le faltan a la luz blanca. En la representación siguiente se muestra cómo se realiza el espectro de absorción del átomo de hidrógeno:

A continuación tienes una representación del espectro de absorción de un átomo de sodio:

Cada elemento o sustancia tiene unos espectros de emisión y absorción característicos. Los de emisión se utilizan con mayor frecuencia ya que aparecen más líneas que además pueden asociarse en unas series representativas.

A continuación tienes una representación del espectro de absorción de un átomo de sodio:
14. ORÍGENES DE LA TEORÍA CUÁNTICA.
El modelo de Rutherford, basado en la concentración de carga positiva en el núcleo de los átomos girando los electrones en órbitas a enorme distancia del núcleo en relación a su tamaño, explicaba la gran penetrabilidad de determinadas partículas en la materia. Sin embargo, pronto se vieron algunos inconvenientes que sugerían que debía cambiarse la teoría atómica:
14.1. Hipótesis de Plank. Cuantización de la energía.
El estudio de estas rayas espectrales permitió relacionar la emisión de radiaciones de determinada “l“ con cambios energéticos asociados a saltos electrónicos. Así Plank supuso que la energía estaba cuantizada, al igual que ocurría con la masa o la carga; es decir, la energía absorbida o desprendida de los átomos sería un múltiplo de una cantidad establecida o “cuanto” que correspondería a la energía correspondiente a la energía emitida o absorbida por un átomo.
Así, si un átomo emite radiación de frecuencia “n”, la energía desprendida por dicho átomo sería:
 Y la energía total emitida será por tanto un múltiplo de esta cantidad, según el número de átomos que emitan: E = n h x n, en donde h = 6,626 10–34 Jx s (Constante de Plank) y "n" es un número entero (nº de átomos emisores), lo cual significa que la energía ganada o cedida por un átomo es un múltiplo de la cantidad de energía mínima(h x n) . Como lógicamente el número de átomos es muy grande y la constante “h” muy pequeña, en la práctica no se aprecia esta cuantización, al igual que sucede con la masa.
Y la energía total emitida será por tanto un múltiplo de esta cantidad, según el número de átomos que emitan: E = n h x n, en donde h = 6,626 10–34 Jx s (Constante de Plank) y "n" es un número entero (nº de átomos emisores), lo cual significa que la energía ganada o cedida por un átomo es un múltiplo de la cantidad de energía mínima(h x n) . Como lógicamente el número de átomos es muy grande y la constante “h” muy pequeña, en la práctica no se aprecia esta cuantización, al igual que sucede con la masa.
El modelo de Rutherford, basado en la concentración de carga positiva en el núcleo de los átomos girando los electrones en órbitas a enorme distancia del núcleo en relación a su tamaño, explicaba la gran penetrabilidad de determinadas partículas en la materia. Sin embargo, pronto se vieron algunos inconvenientes que sugerían que debía cambiarse la teoría atómica:
- Explicación de los espectros atómicos.
- La no emisión de energía por el giro de los electrones (se sabía por entonces que al girar partículas cargadas, éstas deberían emitir energía en forma de radiación electromagnética, lo que inevitablemente conduciría a los electrones a “caer” hacia el núcleo produciendo un colapso de los átomos).
14.1. Hipótesis de Plank. Cuantización de la energía.
El estudio de estas rayas espectrales permitió relacionar la emisión de radiaciones de determinada “l“ con cambios energéticos asociados a saltos electrónicos. Así Plank supuso que la energía estaba cuantizada, al igual que ocurría con la masa o la carga; es decir, la energía absorbida o desprendida de los átomos sería un múltiplo de una cantidad establecida o “cuanto” que correspondería a la energía correspondiente a la energía emitida o absorbida por un átomo.
Así, si un átomo emite radiación de frecuencia “n”, la energía desprendida por dicho átomo sería:
Ejemplo:
¿Puede un elemento cuya única raya del visible tenga una longitud de onda de 5,89 x 10‑7 m absorber una radiación de 4,70 x10-19 J?

En este caso no puede absorber 4,70 x10-19 ya ue este valor de energía no ser un es múltiplo de 3,374 x 10-19 J.
¿Puede un elemento cuya única raya del visible tenga una longitud de onda de 5,89 x 10‑7 m absorber una radiación de 4,70 x10-19 J?

En este caso no puede absorber 4,70 x10-19 ya ue este valor de energía no ser un es múltiplo de 3,374 x 10-19 J.
14.2. Efecto fotoeléctrico. Teoría corpuscular.
Algunos metales al incidir una determinada radiación sobre ellos emiten electrones. Este fenómeno es utilizado prácticamente para cerrar un circuito que, por ejemplo, abra las puertas de un ascensor…
Algunos metales al incidir una determinada radiación sobre ellos emiten electrones. Este fenómeno es utilizado prácticamente para cerrar un circuito que, por ejemplo, abra las puertas de un ascensor…


Se sabe que la capacidad para emitir electrones no depende de la intensidad de la radiación sino únicamente de su frecuencia “n”, es decir, un haz muy luminoso de baja frecuencia puede no producir ionización, mientras que uno mucho menos luminoso pero de mayor frecuencia, si. La frecuencia mínima para extraer un electrón de un átomo (efecto fotoeléctrico) se denomina “frecuencia umbral “n0”.
Einstein, aplicando la hipótesis de Plank, elaboró la teoría corpuscular, en la que suponía que la luz estaba formada por partículas, a los que denominó “fotones” cuya energía venía determinada por E = h · n. Si dicha energía se igualaba o superaba a la energía de ionización se producía la ionización del electrón.



Ejemplo:Calcula la energía de fotones de rayos X cuya longitud de onda es de 0,6 nm.(h = 6,625 x 10–34 J s)

E = h x n = 6,625 x 10–34 J s x 5 x 1017 s–1 = 33,125 x 10–17 J = 3,3125 x 10–16 J
No hubo ningún científico que propusiera una teoría que explicara el fenómeno de los espectros hasta que Bohr, proponiendo su modelo atómico, en 1913, los explicó. Dicho modelo se puede resumir en los siguientes puntos:
- El electrón del átomo de Hidrógeno describe una órbita circular alrededor del núcleo.
- En el átomo, el electrón sólo puede estar en ciertos estados permitidos (determinadas órbitas). Cada una de estas órbitas tiene una energía fija y definida.
- El menor estado energético en el que el e‑ puede encontrarse se llama estado fundamental. Cuando el e‑ se encuentra en un estado energético más elevado (estado excitado), puede "saltar" a otro menor emitiendo un cuanto de energía h.u, correspondiente a las diferencias de energías de los dos estados.
- Sólo pueden existir aquellos estados del movimiento electrónico cuyo momento angular (m.v.r), sea múltiplo de h/2p.

que es la expresión de los radios de las órbitas permitidas. A “n” se le llama número cuántico principal y puede tomar valores enteros positivos desde 1 hasta infinito.
Para comprender el modelo atómico de Bohr hay que tener presente dos cosas:
No todas las órbitas son posibles. Los radios de las permitidas que podemos expresar de la siguiente manera, donde K es una constante y n el número cuántico principal:


No todas las energías son posibles. La energía está cuantizada. Cada órbita tiene una energía fija y definida que viene dada por la ecuación (6):


Observa que la primera órbita, la más cercana al núcleo, es la que menos energía posee.
Cuando un átomo es excitado, mediante una llama o un arco eléctrico, sus electrones ganan energía y pasan a órbitas más energéticas (más alejadas del núcleo) y posteriormente, al enfriarse, vuelven a niveles inferiores emitiendo la diferencia de energía entre las dos órbitas, que viene dada por la ecuación (7).
El modelo atómico de Bohr constituyó la primera explicación cuantitativa del átomo, pero para ello hubo que abandonar los principios de la mecánica clásica (energía está cuantizada). Por ello la teoría de Bohr es la primera teoría cuántica del átomo. Sin embargo, el átomo de Bohr no es capaz de explicar los espectros de átomos plurielectrónicos, tan solo explica el del átomo de hidrógeno.
Todas estas ideas se resumen diciendo que tanto la energía como la materia son discontinuas. Algunas de las teorías que surgieron de la mecánica cuántica son:
16.1. Hipótesis de De Broglie (1924): Planck y Einstein dedujeron la naturaleza dual de la luz (onda-partícula) y De Broglie trasladó esta teoría a cualquier tipo de partícula material.
Al combinar las ecuaciones de Einstein y de Planck:

que para cualquier otra partícula, con una velocidad distinta a la de la luz:

16.2. Principio de incertidumbre de Heisemberg (1927): "Es imposible determinar simultáneamente la posición y la velocidad de una partícula con absoluta precisión y exactitud". También demostró que el error más pequeño que se puede cometer es:

Actualmente no se habla de órbitas sino de zonas donde es probable encontrar al electrón. A dichas zonas se las llama orbital atómico y se definen como la zona del espacio que encierra entre un 90 y un 99% de la probabilidad de encontrar el electrón en un estado energético constante.
16.2.1. Orbitales atómicos.
Según ya sabemos los electrones de un átomo se sitúan en orbitales, los cuales tienen capacidad para situar dos de ellos, según el siguiente esquema:
Los orbitales atómicos tienen distintas formas; así, los orbitales “s” son esféricos; sin embargo el resto de los tipos de orbitales poseen direcciones concretas en el espacio; por ejemplo cada uno de los orbitales “p” se alinea sobre cada uno de los tres ejes de coordenadas.
Según ya sabemos los electrones de un átomo se sitúan en orbitales, los cuales tienen capacidad para situar dos de ellos, según el siguiente esquema:
· 1ª capa: 1 orb. “s” (2 e–)
· 2ª capa: 1 orb. “s” (2 e–) + 3 orb. “p” (6 e–)
· 3ª capa: 1 orb. “s” (2 e–) + 3 orb. “p” (6 e–) + 5 orb. “d” (10 e–)
· 4ª capa: 1 orb. “s” (2 e–) + 3 orb. “p” (6 e–) + 5 orb. “d” (10 e–) + 7 orb. “f” (14 e–)
Y así sucesivamente…Los orbitales atómicos tienen distintas formas; así, los orbitales “s” son esféricos; sin embargo el resto de los tipos de orbitales poseen direcciones concretas en el espacio; por ejemplo cada uno de los orbitales “p” se alinea sobre cada uno de los tres ejes de coordenadas.
16.3. Ecuación de Schrödinger: Como todas las partículas pueden comportarse como ondas se pensó en describir al electrón mediante las ecuaciones matemáticas de las ondas. El primero que lo hizo fue Schorödinger en 1927 (mecánica ondulatoria).
Cuando se soluciona un problema en mecánica clásica se obtiene la posición y velocidad de un objeto, sin embargo en mecánica ondulatoria la solución viene dada por funciones de onda Y. Dicha función de ondas no tiene significado físico real, sin embargo, su cuadrado (Y2) es una medida directa de la probabilidad de encontrar al e‑ en una determinada región del espacio. En consecuencia, las representaciones de los cuadrados de las funciones de onda, constituyen una expresión matemática del orbital atómico. En el punto siguiente tienes algunas de las citadas representaciones.
17. LOS NÚMEROS CUÁNTICOS
Cada función de onda viene determinada por una serie de números cuánticos y sólo son permitidas las funciones de onda de determinados conjuntos de números cuánticos que sirven también para definir el orbital atómico. Estos números cuánticos son tres:
17.1. Número cuántico principal ("n") º 1, 2, 3, ...,
expresa la mayor o menor probabilidad de encontrar al e‑ cerca del núcleo, (a mayor n, el e‑ estaría más tiempo alejado del núcleo). Indica el número de capa o nivel energético de la misma.
17.2. Número cuántico secundario ("l") º 0, ..., n‑1, para cada "n;
especifica el momento angular del electrón en su movimiento alrededor del núcleo y determina la forma espacial del orbital. Indica el número de subniveles energéticos que pueden existir en un nivel dado. Por razones históricas, a cada valor de este número cuántico se le designa por una letra:
|
El número cuántico principal y el secundario determinan conjuntamente la energía del orbital en un átomo.
17.3. Número cuántico magnético ("m") º ‑ l, ... ,0 , ..., + l, para cada "l"
17.3. Número cuántico magnético ("m") º ‑ l, ... ,0 , ..., + l, para cada "l"
representa la orientación de la forma espacial de cada orbital según un eje arbitrario de referencia que viene dado por un campo magnético externo.
A todos los orbitales atómicos con los mismos números cuánticos principal y secundario se les llama orbitales degenerados ya que poseen la misma energía, aunque posean distinto número cuántico magnético. Sin embargo, con la presencia de un campo magnético externo, esta igualdad energética se rompe, ya que la distinta orientación espacial hace que sus interacciones con el campo magnético y por lo tanto, sus contenidos energéticos, sean ligeramente diferentes.
Este desdoblamiento no ocurre con los orbitales "s" ya que tienen simetría esférica, pero sí con todos los demás, es decir, los "p", "d", "f", ... Este fenómeno se pone de manifiesto al realizar el espectro de un átomo en el interior de un campo magnético, ya que al haber más niveles energéticos diferentes, aparecen más líneas espectrales, ya que aumenta el número de tránsitos electrónicos posibles. A este efecto se le denomina Efecto Zeeman.


Los tres números cuánticos, antes descritos, definen un orbital; su tamaño, su forma y su orientación, así como su energía:

Los tres números cuánticos, antes descritos, definen un orbital; su tamaño, su forma y su orientación, así como su energía:

n = 1 , l = 0 , m = 0 à (1 , 0 , 0) à orbitales 1s
n = 3 , l = 2 , m = 1 à (3 , 1 , 1) à orbitales 3px
n = 5 , l = 2 , m = ‑2 à (5 , 2 , -2) à orbitales 5dxy
Es importante recordar que no todas las posibilidades de números cuánticos están permitidas, sólo aquellas que cumplen los rangos de validez de cada uno de ellos, por ejemplo, estos tríos de números cuánticos no podrían representar a un orbital de un átomo:
(0 , 0 , 0) à n no puede tomar el valor de 0(2 , 2 , 1) à l no puede tomar el valor 2 si n toma el valor de 2(3 , 1 , 2) à m no puede tomar el valor 2 si l toma el valor de 1

Para n = 2 existen cuatro orbitales, de acuerdo con el rango de validez de los números cuánticos:


En cada capa "n" hay n² orbitales. Compruébalo para n=4 y n=5.
Nºcuántico "n"
| 1 | 2 | 3 | 4 | 5 | ... | n |
Nº de orbitales
| 1 | 4 | 9 | 16 | 25 | ... | n2 |




En 1928, Dirac, al combinar la teoría cuántica con la teoría relativista, introdujo un cuarto número cuántico para designar al electrón:
17.4. número cuántico de Spín "s" º +½ ,‑½
Clásicamente representa el movimiento de rotación del electrón alrededor de sí mismo. El electrón, como carga eléctrica en movimiento, crea un campo magnético que puede ser del mismo sentido o de sentido opuesto a otro campo magnético externo. Al poder tener sólo dos sentidos de giro sobre sí mismo, "s" sólo podrá tomar 2 valores +½ y ‑½.Los electrones de spines opuestos, como dos imanes colocados paralelamente y de sentido opuesto, se atraen, compensando las fuerzas de repulsión electrostática, quedando éstos apareados.
Por otro lado, los electrones de spines paralelos, al igual que dos imanes colocados paralelamente y en el mismo sentido, se repelen. Es imposible aparear dos electrones del mismo spín por las repulsiones de las fuerzas eléctrica y magnética.
Para determinar a un electrón, hay que indicar el orbital atómico en el que se encuentra y su spín, es decir, hacen falta cuatro números cuánticos:
 Como en cada capa hay n² orbitales, en cada una de ellas cabrán un máximo de 2n² electrones:
Como en cada capa hay n² orbitales, en cada una de ellas cabrán un máximo de 2n² electrones:
Para determinar a un electrón, hay que indicar el orbital atómico en el que se encuentra y su spín, es decir, hacen falta cuatro números cuánticos:

Nºcuántico "n"
| 1 | 2 | 3 | 4 | 5 | ... | n |
Nº de orbitales
| 1 | 4 | 9 | 16 | 25 | ... | n2 |
Nº de electrones
| 2 | 8 | 18 | 32 | 50 | ... | 2n2 |
La mecánica cuántica se basa en asignar una función de onda a los electrones de los átomos para describir su movimiento y estado energético. Dicha función de ondas, se puede escribir para todos los átomos plurielectrónicos, pero sólo se ha podido resolver para el átomo de hidrógeno dada su sencillez (sólo un protón en el núcleo y un electrón en la corteza).
Esta imposibilidad en la resolución de la función de onda, surge de la gran complejidad matemática que resulta debido a la interacción de varios electrones y protones entre sí, por eso, se han tenido que resolver mediante aproximaciones.
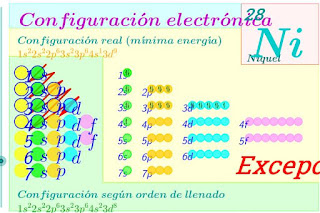
18. CONFIGURACIÓN ELECTRÓNICA
Una vez conocidos los orbitales atómicos de un átomo, sólo nos hace falta saber cómo son ocupados éstos por los electrones en estado fundamental o de mínima energía. A este proceso se le llama hallar la configuración electrónica de un átomo. Para ello, hay que seguir una serie de reglas:
Los electrones se van situando en los distintos orbitales siguiendo los siguientes principios:
· Principio de mínima energía (aufbau): “Los electrones se colocan siguiendo el criterio de mínima energía, es decir, se rellenan primero los niveles con menor energía y no se rellenan niveles superiores hasta que no estén completos los niveles inferiores”.
- Principio de exclusión de Pauli: Fue establecido por Wolfgang Pauli (1900-1958) en 1927, y establece que en un átomo no pueden existir 2 electrones con los 4 números cuánticos iguales. Esto es, en cada orbital caben como máximo 2 electrones, con espines opuestos. Este principio implica que en cada orbital s existirán como máximo 2 electrones; en los 3 orbitales p, 6; en los 5 orbitales d, 10; y en los 7 orbitales f, 14.
- Principio de construcción o “aufbau” (orden de energía creciente): Esta regla y la siguiente constituyen el principio de construcción o de aufbau. Establece que los orbitales en que se pueden encontrar los electrones se van “llenando” en orden creciente de energía. El orden creciente de energía de los orbitales depende de la suma de los números cuánticos n + l (cuanto mayor sea esta suma, más energético será el orbital), y viene dado por el diagrama de Möeller (ver figura a la izquierda).
- Regla de máxima multiplicidad de Hund: Los electrones situados en orbitales de la misma energía (o en el mismo nivel energético) tienden a situarse lo más desapareados (o separados) que sea posible. Es decir, al ocupar orbitales con el mismo valor de l pero distinto valor de m, los electrones ocupan el mayor número de orbitales con distinto valor de m.
De las tres reglas anteriores deducimos que el número máximo de electrones en cada nivel energético es 2n 2
,
siendo n el nº cuántico principal del nivel.
 Al ocupar los orbitales degenerados (de energías equivalentes), cada uno de ellos ha de estar ocupado por un electrón antes de asignar un segundo electrón a cualquiera de ellos. Los spines de estos electrones deben ser iguales (regla de la máxima multiplicidad de Hund).
Al ocupar los orbitales degenerados (de energías equivalentes), cada uno de ellos ha de estar ocupado por un electrón antes de asignar un segundo electrón a cualquiera de ellos. Los spines de estos electrones deben ser iguales (regla de la máxima multiplicidad de Hund).
Por ejemplo, la configuración electrónica del Azufre sería
la del ion sodio Na+ (al tener carga +1, tendrá un electrón menos):
la del hierro:
y la del bromo:
La configuración electrónica sirve para conocer los e‑ que hay en la última capa, y ésto es muy importante ya que, átomos de configuración electrónica de última capa similar tienen propiedades químicas parecidas. De hecho, la ordenación de los elementos en el sistema periódico actual se basa en las configuraciones electrónicas.

ANIMACIONES









19. EVOLUCIÓN HISTÓRICA DEL SISTEMA PERIÓDICO
A medida que a principios del siglo XIX se fueron descubriendo más sustancias que se identificaron como elementos, los investigadores dispusieron de datos cada vez más abundantes, y observaron que las propiedades de algunos eran muy semejantes.
La primera clasificación de los elementos que se propuso fue la de metales y no metales.
Más adelante se observó que podían establecerse grupos de tres elementos con propiedades muy similares de tal manera que el peso atómico del intermedio fuese aproximadamente igual a la media de los otros dos. Esta fue la llamada clasificación por "triadas", por ejemplo: cloro-bromo-iodo, azufre-selenio-teluro, calcio-estroncio-bario, etc..
Se siguió la búsqueda de un sistema de ordenación mejor y en 1864 Newlans encontró, agrupando las triadas en forma vertical de modo que cada elemento siguiese en sentido horizontal un orden creciente de pesos atómicos correlativos, la denominada "ley de las octavas", es decir, que tenían propiedades diferentes 8 elementos y el noveno coincidía con las propiedades del primer grupo.
No obstante a partir del K esta regla dejaba de cumplirse, motivo por el cual se desestimó.
En 1869 Mendeleiev consideró correcto el sistema de Newlans y argumentó que los períodos no tenían porque ser de la misma longitud. Lo importante fue queMendeleiev postuló que las propiedades físicas y químicas de los elementos son función periódica de sus pesos atómicos.

Mendeleiev ordenó los elementos en 7 filas horizontales y 8 verticales con subdivisiones dentro de cada cuadro cuando era necesario. Con algunas modificaciones, éste es el sistema periódico vigente en nuestros días.
La clasificación periódica de los elementos tuvo gran importancia en aquella época ya que se pudo predecir la existencia de algunos elementos aún no descubiertos así como sus propiedades, gracias a que Mendeleiev dejó vacantes algunos lugares para mantener la correlación de las propiedades. Así se descubrió el ekaboro, (escandio), el ekaluminio, (galio) y el ekasilicio, (germanio) entre otros.
Los principales inconvenientes de la tabla de Mendeleiev eran los siguientes:
En la tabla periódica actual cada elemento se caracteriza por su fila y su columna. Las filas se denominan periodos, (hay 7 periodos, 3 cortos y 4 largos), y las columnas son grupos. Cada grupo tiene un nombre característico.

20. ESTRUCTURA ELECTRÓNICA Y SISTEMA PERIÓDICO
Es interesante ver como varían las configuraciones electrónicas dentro del mismo grupo o de un mismo periodo en el Sistema Periódico.
Dentro de un mismo grupo todos poseen la misma estructura en el último nivel de energía. Como veremos en el tema siguiente, la semejanza de propiedades químicas dentro de un mismo grupo se debe a esta característica.
En un periodo cada elemento se diferencia del anterior en que tiene un e‑ más. Esta diferencia es suficiente para un cambio radical en las propiedades.
Viendo la posición que ocupa un elemento en la tabla periódica se puede hallar su configuración electrónica:

Hay algunas excepciones. Por ejemplo el Cr (Z=24) debería ser 4s2 3d4 y, sin embargo, en realidad es 4s1 3d5 debido a que los orbitales 4s y 3d son de energías muy parecidas y la energía debida al desapareamiento de los e‑ compensa. Lo mismo les ocurre a los que poseen 9 e‑ en los 5 orbitales d.Ley de las octavas de Newlands (1864): se llama así por su parecido con la escala musical. Este científico ordenó los elementos en grupos de 7, observando que el 8º elemento tenía propiedades similares al 1º:
A la vista de todo ésto, podemos clasificar los elementos en 4 categorías:
 20.1. Propiedades eléctricas
20.1. Propiedades eléctricas
Los elementos de la derecha no son conductores y se llaman no metales. Son elementos con muchos electrones en la última capa y que tienen tendencia a ganar para completarla cargándose negativamente formando aniones.
 Los elementos de la diagonal se llaman semimetales. La clasificación no es tan clara en las proximidades de la diagonal.
Los elementos de la diagonal se llaman semimetales. La clasificación no es tan clara en las proximidades de la diagonal.
ANIMACIONES

20.2. Energía de ionización
La energía de ionización, o también llamada potencial de ionización, es la energía mínima necesaria para arrancar a un átomo en estado gaseoso su electrón más externo (el más débilmente unido a él).
 Las ecuaciones que rigen este proceso son:
Las ecuaciones que rigen este proceso son:
se puede comprobar que: EI1 < EI2 < EI3
ya que costará menos arrancar un electrón a un átomo neutro que a un átomo cargado positivamente, con defecto de electrones. Hay que tener en cuenta que en el momento en el que se vacía una subcapa, y se separa el primer electrón de la subcapa inmediatamente inferior, se produce un salto pronunciado de la energía de ionización, por ejemplo:
los valores están dados en eV (electrón-voltios), que es la energía de un electrón acelerado a través de una diferencia de potencial de un voltio y que equivale a 1'602.10‑19J.
Influyen tres factores en la energía de ionización:


20.3. Afinidad electrónica
La afinidad electrónica o electroafinidad es la energía generalmente desprendida cuando un átomo en estado gaseoso capta un electrón transformándose en un ion negativo.

La ecuación química que la representa es:
mientras que la AE1 es generalmente una energía desprendida, es decir, negativa, la AE2 es siempre energía absorbida, ya que el segundo electrón a captar es repelido por el anión formado al haber captado ya el primero.


El hecho de que la primera energía de afinidad electrónica sea generalmente una energía desprendida, significa que el anión formado es más estable que el átomo neutro. Esta situación es bastante probable para los elementos situados a la derecha de la tabla periódica (a excepción de los gases nobles) ya que estos tienen tendencia a ganar electrones para adquirir configuración electrónica de gas noble. Por el contrario, los situados a la izquierda, tendrán una baja afinidad electrónica ya que lo que tienen tendencia es a perder electrones y no a captarlos.
En un grupo suele aumentar a medida que disminuye el número atómico, ya que al ser átomos más pequeños, el electrón que se capta queda más influenciado por la cercanía del núcleo.
Resumiendo, la variación de la afinidad electrónica a lo largo del sistema periódico es similar a la del potencial de ionización, sin embargo existen más irregularidades.
 Estos datos te ayudarán a observar la variación de la afinidad electrónica a lo largo del sistema periódico, tanto en un período como en un grupo:
Estos datos te ayudarán a observar la variación de la afinidad electrónica a lo largo del sistema periódico, tanto en un período como en un grupo:
ANIMACIONES

20.4. Electronegatividad
Es un concepto que trata de sintetizar los dos anteriores. Mide la tendencia que posee un átomo para atraer hacia sí el par, o los pares, de electrones que comparte con otro a través de un enlace covalente.
Varía igual que la Energía de Ionizacón a lo largo del Sistema Periódico. Los gases nobles quedan excluidos de esta tendencia, ya que su electronegatividad es prácticamente nula, debido a su dificultad para formar enlaces covalentes, ya que al tener la última capa completa, no tienen tendencia ni a ganar ni a perder electrones. El elemento más electronegativo es el flúor y el menos electronegativo el Cesio.
La electronegatividad está relacionada con el carácter metálico o no metálico de un elemento; así, los elementos de alta electronegatividad serán No metales y los de baja electronegatividad metales.


ANIMACIONES
20.5. Radio atómico e iónico
El principio de incertidumbre de Heisemberg indica que es imposible saber con precisión y simultáneamente la posición y velocidad de un electrón en el interior de un átomo. Como consecuencia de ello, hemos definido los orbitales atómicos como zonas del espacio donde es probable encontrar al electrón con un
El método más efectivo para medir el radio de un átomo consiste en determinar, por difracción de rayos X, la distancia internuclear que existe dos elementos que forman un enlace covalente simple en estado gaseoso y dividirla por la mitad, tal y como muestra la figura de la derecha.
En el caso de los elementos metálicos, la distancia internuclear se determina por el mismo procedimiento pero sobre la estructura cristalina de la sustancia metálica.
El radio atómico crece de arriba a abajo dentro de un mismo grupo, ya que aumenta el número de capas internas y por lo tanto será de mayor tamaño, y aumenta de derecha a izquierda en un mismo período debido a que los e‑ se van colocando en el mismo nivel (a la misma distancia del núcleo aproximadamente) y la fuerza de atracción entre los e‑ y el núcleo es más fuerte a medida que aumenta el número de protones, por tanto, el volumen es menor.
Sin embargo, en los períodos largos, esta atracción es compensada por el llamado efecto de apantallamiento de los e‑ que consiste en que a medida que se van llenando los niveles periféricos, las repulsiones entre los e‑ aumentan, con lo que los e‑ periféricos no experimentan tanta atracción por el núcleo. y quedan más sueltos aumentando, por lo tanto, el radio del átomo.
 El siguiente gráfico te puede ayudar a ver con mayor claridad la evolución del radio atómico a lo largo del Sistema periódico:
El siguiente gráfico te puede ayudar a ver con mayor claridad la evolución del radio atómico a lo largo del Sistema periódico:

tenderá a perder 1 e‑ quedando como Na+  2s2 2p6
2s2 2p6
Un caso interesante es el de los elementos del grupo IIIa, que tienen una configuración electrónica ns² np1. En teoría los cationes más estables serían los formados por la pérdida de 3 e‑, Al+3, Ga+3, lo que es cierto, pero a medida que aumenta el número atómico, aumenta la tendencia a eliminar sólo el e‑ p, hasta el punto que en el Tl la valencia más importante es +1.
En otros grupos ocurre lo mismo, Pb+2 es más estable que Pb+4, mientras que el Si y el Ge actúan siempre como tetravalentes.
A partir del grupo Va se advierte la tendencia de los elementos a formar iones negativos sobre todo en los elementos superiores; N y P captan 3 e‑ para adquirir configuración electrónica de gas noble, sin embargo, en el As este estado de oxidación no tiene importancia y en el Bi ni siquiera existe.
Para los elementos de transición este estudio es mucho más complejo debido a la gran variedad de estados. El estado máximo de oxidación corresponde al catión con carga positiva igual al número del grupo al que pertenece, por ejemplo Cr+6, (VIb).
Los estados de oxidación inferiores son más estables en el primer periodo largo, (Fe+2, Fe+3), y a medida que bajamos en el grupo, el estado de oxidación mayor se hace más estable:
Una excepción a todo ésto son los grupos Ib y IIb.







Masa atómica
Volumen atómico
Densidad
Punto de fusión
Punto de ebullición
Radio atómico
Radio covalente
Afinidad electrónica
1ª Energía ionización
2ª Energía ionización
3ª Energía ionización
Conduc. eléctrica
Electronegatividad
Polarizabilidad
Entalpía atomización
Entalpía de fusión
Entalpía vaporización
Calor específico
Conductividad térmica
OTRAS TABLAS PERIÓDICAS


































21. RESUMEN
Principio de exclusión de Pauli.
En la estructura electrónica de un átomo no pueden existir dos electrones que tengan iguales los cuatro números cuánticos
Principio de máxima multiplicidad, Hund. Los electrones, al ocupar un subnivel, deberán distribuirse en el mayor número de orbitales posible y de forma que sus spines sean paralelos.
El sistema periódico consiste en al ordenación de los elementos actualmente conocidos según su número atómico creciente, en siete filas (períodos) y 16 columnas, una de ellas triple (grupos o familias), de tal forma que se correspondan en columna los elementos de propiedades análogas. Cada elemento tiene un número atómico superior en una unidad al que le procede, lo cual se traduce en la existencia de un electrón más (electrón diferenciador), que se dispondrá en el orbital disponible de mínima energía.
Propiedades periódicas:
• Potencial de ionización. Se denomina primera energía de ionización, Ei , la energía mínima necesaria para separa un electrón de un átomo neutro gaseoso en su estado fundamental. En el S.P. la Ei aumenta de izquierda a derecha y de abajo arriba.
• Afinidad electrónica, Ae
, es la energía que se desprende cuando un átomo gaseoso en su estado
elemental capta un electrón y se convierte en un ión negativo gaseoso. En el S.P. la Ae
aumenta de
izquierda a derecha y de abajo arriba.
• Electronegatividad, Xe
, es la tendencia de un átomo de ese elemento que forma parte de una
molécula atraer los electrones que forman el enlace covalente, hacia sí. En el S.P. la Xe
, aumenta de
izquierda a derecha y de abajo arriba.
• Carácter metálico. La electronegatividad es una propiedad que sirve para clasificar a los elementos en metales y no metales. Los metales se caracterizan por una Xe baja, mientras que en los no metales es alta.
• Valencia iónica. Es el número de electrones que gana o pierde un átomo para formar un ión estable. Esta relacionado con su estructura electrónica.
• Volumen atómico. Se denomina así el volumen ocupado por 1 mol de átomos del elemento. En un grupo disminuye de abajo arriba, en un periodo disminuye al principio del periodo, debido al aumento de la carga nuclear, pero aumenta al final del mismo debido al efectos de repulsión electrostática entre los e− apareados.
• Radio atómico, suponiendo al átomo según el modelo de Tompson, aumenta con el valor de Z, es decir, hacia abajo, ya que el número de niveles electrónicos crece en ese mismo sentido. En los periodos cortos el radio atómico disminuye al aumentar Z, desde el elemento alcalino hasta el halógeno, aumentando al pasar al gas noble inmediato y al periodo siguiente. Esto se debe al aumento progresivo de la carga nuclear, que atrae cada vez con más fuerza a los electrones periféricos, provocando la correspondiente contracción a lo largo del periodo. En los periodos largos la variación es más irregular, existiendo dos mínimos; uno hacia el centro del periodo y otro en el halógeno correspondiente.










23. CUESTIONES
24. OTROS CONTENIDOS
Estructura atómica
Átomo, tabla periódica y enlaces
Estructura atómica 1
Estructura atómica 2
Apuntes ampliados
Otros apuntes
Átomo, sistema periódico y enlaces
Teoría átomo
25. VÍDEOS
Hibridación
Electronegatividad
El gato se Schrodinger
Modelos atómicos
Experimento de Rutherford
Modelo de Bohr
Modelos atómicos 2
Experimento de Rutherford
Absorción de luz por un electrón
Emisión de luz por un electrón
Espectros atómicos de absorción
Radio atómico (vi)
Formación del enlace en la molécula de hidrógeno

Por ejemplo, la configuración electrónica del Azufre sería
| S (Z=16): |
1s2 , 2s2 , 2p6 ,
| 3s2 , 3p4 |
la del ion sodio Na+ (al tener carga +1, tendrá un electrón menos):
| Na+ (Z=11): |
1s2 ,
| 2s2 , 2p6 |
la del hierro:
| Fe (Z=26): |
1s2 , 2s2 , 2p6 ,3s2 ,3p6,
| 4s2 , 3d6 |
| |
y la del bromo:
| Br (Z=35): |
1s2 , 2s2 , 2p6 ,3s2 ,3p6,
| 4s2 , 3d10, 4p5 |
| |
ANIMACIONES










19. EVOLUCIÓN HISTÓRICA DEL SISTEMA PERIÓDICO
A medida que a principios del siglo XIX se fueron descubriendo más sustancias que se identificaron como elementos, los investigadores dispusieron de datos cada vez más abundantes, y observaron que las propiedades de algunos eran muy semejantes.
La primera clasificación de los elementos que se propuso fue la de metales y no metales.
Más adelante se observó que podían establecerse grupos de tres elementos con propiedades muy similares de tal manera que el peso atómico del intermedio fuese aproximadamente igual a la media de los otros dos. Esta fue la llamada clasificación por "triadas", por ejemplo: cloro-bromo-iodo, azufre-selenio-teluro, calcio-estroncio-bario, etc..
Se siguió la búsqueda de un sistema de ordenación mejor y en 1864 Newlans encontró, agrupando las triadas en forma vertical de modo que cada elemento siguiese en sentido horizontal un orden creciente de pesos atómicos correlativos, la denominada "ley de las octavas", es decir, que tenían propiedades diferentes 8 elementos y el noveno coincidía con las propiedades del primer grupo.
No obstante a partir del K esta regla dejaba de cumplirse, motivo por el cual se desestimó.
En 1869 Mendeleiev consideró correcto el sistema de Newlans y argumentó que los períodos no tenían porque ser de la misma longitud. Lo importante fue queMendeleiev postuló que las propiedades físicas y químicas de los elementos son función periódica de sus pesos atómicos.
Mendeleiev ordenó los elementos en 7 filas horizontales y 8 verticales con subdivisiones dentro de cada cuadro cuando era necesario. Con algunas modificaciones, éste es el sistema periódico vigente en nuestros días.
La clasificación periódica de los elementos tuvo gran importancia en aquella época ya que se pudo predecir la existencia de algunos elementos aún no descubiertos así como sus propiedades, gracias a que Mendeleiev dejó vacantes algunos lugares para mantener la correlación de las propiedades. Así se descubrió el ekaboro, (escandio), el ekaluminio, (galio) y el ekasilicio, (germanio) entre otros.
Los principales inconvenientes de la tabla de Mendeleiev eran los siguientes:
- La ordenación por pesos atómicos presentaba algunas discrepancias. Así Ar-K, Co-Ni, Te-I, quedan colocados en orden inverso para mantener la correlación de las propiedades. Hoy se ordenan los elementos no por pesos atómicos, sino por los números atómicos, con lo que estos pares quedan perfectamente ordenados y ésto es lógico porque el número atómico es un factor determinante en la configuración electrónica de última capa del elemento y por lo tanto de sus propiedades.
- El Hidrógeno carecía de ordenación adecuada aunque se le colocaba con los metales alcalinos.
- Los metales y no metales no estaban bien diferenciados, por ejemplo el Pb y el C son metal y no metal estando en la misma columna.
- Un gran número de elementos, (lantánidos y actínidos), no tenían cabida en el sistema periódico.
En la tabla periódica actual cada elemento se caracteriza por su fila y su columna. Las filas se denominan periodos, (hay 7 periodos, 3 cortos y 4 largos), y las columnas son grupos. Cada grupo tiene un nombre característico.

20. ESTRUCTURA ELECTRÓNICA Y SISTEMA PERIÓDICO
Es interesante ver como varían las configuraciones electrónicas dentro del mismo grupo o de un mismo periodo en el Sistema Periódico.
Dentro de un mismo grupo todos poseen la misma estructura en el último nivel de energía. Como veremos en el tema siguiente, la semejanza de propiedades químicas dentro de un mismo grupo se debe a esta característica.
En un periodo cada elemento se diferencia del anterior en que tiene un e‑ más. Esta diferencia es suficiente para un cambio radical en las propiedades.
Viendo la posición que ocupa un elemento en la tabla periódica se puede hallar su configuración electrónica:

Hay algunas excepciones. Por ejemplo el Cr (Z=24) debería ser 4s2 3d4 y, sin embargo, en realidad es 4s1 3d5 debido a que los orbitales 4s y 3d son de energías muy parecidas y la energía debida al desapareamiento de los e‑ compensa. Lo mismo les ocurre a los que poseen 9 e‑ en los 5 orbitales d.Ley de las octavas de Newlands (1864): se llama así por su parecido con la escala musical. Este científico ordenó los elementos en grupos de 7, observando que el 8º elemento tenía propiedades similares al 1º:
- Elementos "normales" - ns1 ns2 np1 ........np5. Cada uno de estos grupos o familias de elementos tienen un nombre característico:
Configuración
|
Nombre del grupo
|
| ns1 | alcalinos (excepto el Hidrógeno) |
| ns2 | alcalinotérreos |
| np1 | térreos |
| np2 | carbonoideos. |
| np3 | nitrogenoideos |
| np4 | anfígenos |
| np5 | halógenos |
- Elementos de transición - ns2 (n‑1)d1 ... ns (n‑1)d10
- Elementos de transición interna - ns2 (n‑1)d1 (n‑2)fy El nivel fpresenta un llenado irregular
- Gases nobles - ns2 np6 (excepto el He que es 1s²).

Los elementos situados a la izquierda de una diagonal formada por B, Si, Ge, As y Te, son conductores de la electricidad y se llaman metales. Son elementos con pocos electrones en la última capa, que tienen tendencia a perderlos para adquirir configuración electrónica de gas noble quedándose, por tanto, cargados positivamente formando cationes.
Los elementos de la derecha no son conductores y se llaman no metales. Son elementos con muchos electrones en la última capa y que tienen tendencia a ganar para completarla cargándose negativamente formando aniones.

ANIMACIONES

20.2. Energía de ionización
La energía de ionización, o también llamada potencial de ionización, es la energía mínima necesaria para arrancar a un átomo en estado gaseoso su electrón más externo (el más débilmente unido a él).

| X (g) + EI1 | à | X+ (g) | 1ª Energía de ionización |
| X+ (g) + EI2 | à | X+2 (g) | 2ª Energía de ionización |
| X+2 (g) + EI3 | à | X+3 (g) | 3ª Energía de ionización |
se puede comprobar que: EI1 < EI2 < EI3
ya que costará menos arrancar un electrón a un átomo neutro que a un átomo cargado positivamente, con defecto de electrones. Hay que tener en cuenta que en el momento en el que se vacía una subcapa, y se separa el primer electrón de la subcapa inmediatamente inferior, se produce un salto pronunciado de la energía de ionización, por ejemplo:
| Elem | Z | Configuración electrónica | EI1 | EI2 | EI3 | EI4 |
| Na | 11 | 1s2 2s2 2p6 3s1 | 5,1 | 47,3 | 71,7 | 98,9 |
| Mg | 12 | 1s2 2s2 2p6 3s2 | 7,6 | 15,0 | 80,1 | 109,3 |
| Al | 13 | 1s2 2s2 2p6 3s2 3p1 | 6,0 | 18,2 | 28,4 | 120,4 |
* eV
| ||||||
Influyen tres factores en la energía de ionización:
- Número atómico: a mayor número atómico, (más protones), mayor será la energía necesaria para ionizarlo.
- Radio atómico: a mayor distancia la fuerza de atracción entre el núcleo y el e‑ disminuye y, por lo tanto, la energía de ionización disminuirá, ya que será más fácil arrancarlo.
- Orbitales atómicos completos o semicompletos, ya que dan estabilidad al átomo y por lo tanto costará más arrancarle un electrón.
- En un grupo aumenta hacia arriba debido a que al pasar de un elemento al inferior, contiene una capa más y por lo tanto, los electrones de la capa de valencia, al estar más alejados del núcleo, estarán menos atraídos por él y costará menos energía arrancarlos.
- En un mismo período, en general, aumenta a medida que nos desplazamos hacia la derecha, ya que los elementos allí situados tienen tendencia a ganar electrones y por lo tanto costará mucho más arrancarlos que a los de la izquierda que, al tener pocos electrones en la última capa les costará mucho menos perderlos.

La afinidad electrónica o electroafinidad es la energía generalmente desprendida cuando un átomo en estado gaseoso capta un electrón transformándose en un ion negativo.

La ecuación química que la representa es:
| X (g) + e- | à | X- (g) + AE1 | 1ª afinidad electrónica |
| X- (g) + e- | à | X-2 (g) + AE2 | 2ª afinidad electrónica |
| X-2 (g) + e- | à | X-3 (g) + AE3 | 3ª afinidad electrónica |
mientras que la AE1 es generalmente una energía desprendida, es decir, negativa, la AE2 es siempre energía absorbida, ya que el segundo electrón a captar es repelido por el anión formado al haber captado ya el primero.


En un grupo suele aumentar a medida que disminuye el número atómico, ya que al ser átomos más pequeños, el electrón que se capta queda más influenciado por la cercanía del núcleo.
Resumiendo, la variación de la afinidad electrónica a lo largo del sistema periódico es similar a la del potencial de ionización, sin embargo existen más irregularidades.

| ||||||||||||||||||||||||||||||||||||||||||

20.4. Electronegatividad
Es un concepto que trata de sintetizar los dos anteriores. Mide la tendencia que posee un átomo para atraer hacia sí el par, o los pares, de electrones que comparte con otro a través de un enlace covalente.
Varía igual que la Energía de Ionizacón a lo largo del Sistema Periódico. Los gases nobles quedan excluidos de esta tendencia, ya que su electronegatividad es prácticamente nula, debido a su dificultad para formar enlaces covalentes, ya que al tener la última capa completa, no tienen tendencia ni a ganar ni a perder electrones. El elemento más electronegativo es el flúor y el menos electronegativo el Cesio.
La electronegatividad está relacionada con el carácter metálico o no metálico de un elemento; así, los elementos de alta electronegatividad serán No metales y los de baja electronegatividad metales.

ANIMACIONES
20.5. Radio atómico e iónico
El principio de incertidumbre de Heisemberg indica que es imposible saber con precisión y simultáneamente la posición y velocidad de un electrón en el interior de un átomo. Como consecuencia de ello, hemos definido los orbitales atómicos como zonas del espacio donde es probable encontrar al electrón con un
determinado estado energético, por lo que no tienen un límite definido, por lo que se hace difícil conocer con precisión el radio de un átomo o un ión.
En el caso de los elementos metálicos, la distancia internuclear se determina por el mismo procedimiento pero sobre la estructura cristalina de la sustancia metálica.
El radio atómico crece de arriba a abajo dentro de un mismo grupo, ya que aumenta el número de capas internas y por lo tanto será de mayor tamaño, y aumenta de derecha a izquierda en un mismo período debido a que los e‑ se van colocando en el mismo nivel (a la misma distancia del núcleo aproximadamente) y la fuerza de atracción entre los e‑ y el núcleo es más fuerte a medida que aumenta el número de protones, por tanto, el volumen es menor.
Sin embargo, en los períodos largos, esta atracción es compensada por el llamado efecto de apantallamiento de los e‑ que consiste en que a medida que se van llenando los niveles periféricos, las repulsiones entre los e‑ aumentan, con lo que los e‑ periféricos no experimentan tanta atracción por el núcleo. y quedan más sueltos aumentando, por lo tanto, el radio del átomo.


Cuando un elemento gana o pierde electrones, se transforma en un ión y el valor de su radio será diferente. La determinación de dichos radios iónicos se hace de manera similar a los radios atómicos pero sobre estructuras cristalinas de compuestos iónicos, formados, como veremos, por iones perfectamente ordenados para maximizar las atracciones entre ellos y minimizar las repulsiones. La distancia que hay entre dos núcleos de dos iones adyacentes en un cristal iónico, es la suma de sus radios iónicos, tal y como muestra la figura de la izquierda:
Podríamos pensar que al tener las tres especies el mismo número de electrones, deberían tener el mismo volumen, sin embargo no es así, ya que el número de protones que hay en el núcleo no es el mismo. La especie Na+, por el hecho de tener más protones en el núcleo (11), atraerá con más fuerza a los 10 electrones y por lo tanto será el más pequeño, mientras que el F- será más grande, es decir:
20.6. Estados de oxidación
Los estados de oxidación (valencias), están en relación con la configuración electrónica de los elementos, por lo tanto, también variaran de forma periódica.
Los estados de oxidación más importantes corresponden a la pérdida o ganancia de e‑ para conseguir una configuración electrónica de gas noble, (ocupación total de los orbitales s y p).
Ejemplo: Na 2s2 2p6 3s1
2s2 2p6 3s1
- El radio de un catión, ión positivo, es menor que el del átomo neutro del mismo elemento, ya que al ser menor el número de electrones, aumenta la carga efectiva del núcleo que atraerá más a los electrones restantes por lo que su tamaño disminuirá.
- El radio de un anión, ión negativo, es mayor que el del átomo neutro del mismo elemento, ya que al tener un electrón más, la carga efectiva del núcleo disminuirá y habrá una mayor repulsión entre los electrones, por lo que el radio aumentará.
| Na+ | z = 11 | 11 protones y 10 electrones | |
| Ne | z = 10 | 10 protones y 10 electrones | |
| F- | z = 9 | 9 protones y 10 electrones |
Na+ < Ne < F-
20.6. Estados de oxidación
Los estados de oxidación (valencias), están en relación con la configuración electrónica de los elementos, por lo tanto, también variaran de forma periódica.
Los estados de oxidación más importantes corresponden a la pérdida o ganancia de e‑ para conseguir una configuración electrónica de gas noble, (ocupación total de los orbitales s y p).
Ejemplo: Na
Un caso interesante es el de los elementos del grupo IIIa, que tienen una configuración electrónica ns² np1. En teoría los cationes más estables serían los formados por la pérdida de 3 e‑, Al+3, Ga+3, lo que es cierto, pero a medida que aumenta el número atómico, aumenta la tendencia a eliminar sólo el e‑ p, hasta el punto que en el Tl la valencia más importante es +1.
En otros grupos ocurre lo mismo, Pb+2 es más estable que Pb+4, mientras que el Si y el Ge actúan siempre como tetravalentes.
A partir del grupo Va se advierte la tendencia de los elementos a formar iones negativos sobre todo en los elementos superiores; N y P captan 3 e‑ para adquirir configuración electrónica de gas noble, sin embargo, en el As este estado de oxidación no tiene importancia y en el Bi ni siquiera existe.
Para los elementos de transición este estudio es mucho más complejo debido a la gran variedad de estados. El estado máximo de oxidación corresponde al catión con carga positiva igual al número del grupo al que pertenece, por ejemplo Cr+6, (VIb).
Los estados de oxidación inferiores son más estables en el primer periodo largo, (Fe+2, Fe+3), y a medida que bajamos en el grupo, el estado de oxidación mayor se hace más estable:
| Grupo VIb: | Cr | Presenta principalmente +3 | |
| Mo | Presenta +4; y +7 sólo en raras ocasiones | ||
| W | Principalmente +6 |
Una excepción a todo ésto son los grupos Ib y IIb.

CARACTERÍSTICAS DE LA TABLA PERIÓDICA






Volumen atómico
Densidad
Punto de fusión
Punto de ebullición
Radio atómico
Radio covalente
Afinidad electrónica
1ª Energía ionización
2ª Energía ionización
3ª Energía ionización
Conduc. eléctrica
Electronegatividad
Polarizabilidad
Entalpía atomización
Entalpía de fusión
Entalpía vaporización
Calor específico
Conductividad térmica
ANIMACIONES
























21. RESUMEN
| Año | Científico | Descubrimientos experimentales | Modelo atómico | ||||||
| 1808 | John Dalton |
|
| ||||||
| 1897 | J.J. Thomson |
|
| ||||||
| 1911 | E. Rutherford |
|
| ||||||
| 1913 | Niels Bohr |
|
| ||||||
Principio de exclusión de Pauli.
En la estructura electrónica de un átomo no pueden existir dos electrones que tengan iguales los cuatro números cuánticos
Principio de máxima multiplicidad, Hund. Los electrones, al ocupar un subnivel, deberán distribuirse en el mayor número de orbitales posible y de forma que sus spines sean paralelos.
El sistema periódico consiste en al ordenación de los elementos actualmente conocidos según su número atómico creciente, en siete filas (períodos) y 16 columnas, una de ellas triple (grupos o familias), de tal forma que se correspondan en columna los elementos de propiedades análogas. Cada elemento tiene un número atómico superior en una unidad al que le procede, lo cual se traduce en la existencia de un electrón más (electrón diferenciador), que se dispondrá en el orbital disponible de mínima energía.
Propiedades periódicas:
• Potencial de ionización. Se denomina primera energía de ionización, Ei , la energía mínima necesaria para separa un electrón de un átomo neutro gaseoso en su estado fundamental. En el S.P. la Ei aumenta de izquierda a derecha y de abajo arriba.
X(g) + Ei → X(g)
+
+ e
X(g) + e− → X(g)
−
+ Ae
• Carácter metálico. La electronegatividad es una propiedad que sirve para clasificar a los elementos en metales y no metales. Los metales se caracterizan por una Xe baja, mientras que en los no metales es alta.
• Valencia iónica. Es el número de electrones que gana o pierde un átomo para formar un ión estable. Esta relacionado con su estructura electrónica.
• Volumen atómico. Se denomina así el volumen ocupado por 1 mol de átomos del elemento. En un grupo disminuye de abajo arriba, en un periodo disminuye al principio del periodo, debido al aumento de la carga nuclear, pero aumenta al final del mismo debido al efectos de repulsión electrostática entre los e− apareados.
• Radio atómico, suponiendo al átomo según el modelo de Tompson, aumenta con el valor de Z, es decir, hacia abajo, ya que el número de niveles electrónicos crece en ese mismo sentido. En los periodos cortos el radio atómico disminuye al aumentar Z, desde el elemento alcalino hasta el halógeno, aumentando al pasar al gas noble inmediato y al periodo siguiente. Esto se debe al aumento progresivo de la carga nuclear, que atrae cada vez con más fuerza a los electrones periféricos, provocando la correspondiente contracción a lo largo del periodo. En los periodos largos la variación es más irregular, existiendo dos mínimos; uno hacia el centro del periodo y otro en el halógeno correspondiente.
22. PRÁCTICAS










Estructura atómica
Átomo, tabla periódica y enlaces
Estructura atómica 1
Estructura atómica 2
abla periódica. Caracteísticas 1
Tabla periódica. Caracteísticas 2
Tabla periódica. Caracteísticas 3
Resumen de clase Tabla periódica. Caracteísticas 2
Tabla periódica. Caracteísticas 3
Apuntes ampliados
Otros apuntes
Átomo, sistema periódico y enlaces
Teoría átomo
25. VÍDEOS
El átomo
|
Dualidad onda-corpúsculo
|
Principio de Incertidumbre
|
Tabla periódica y configuración | Tabla periódica: resumen | Configuración electrónica |
Modelo atómico - resumen | El átomo: modelo de Bohr | El átomo: Schrödinger |
Hibridación
Electronegatividad
El gato se Schrodinger
Modelos atómicos
Experimento de Rutherford
Modelo de Bohr
Modelos atómicos 2
Experimento de Rutherford
Absorción de luz por un electrón
Emisión de luz por un electrón
Espectros atómicos de absorción
Radio atómico (vi)
Formación del enlace en la molécula de hidrógeno

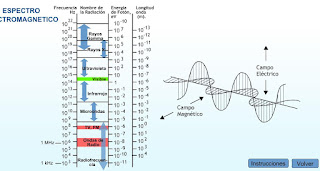

































No hay comentarios:
Publicar un comentario