ÍNDICE
| 7. Enlaces intermoleculares
9. Sólidos moleculares 10. Enlace metálico 11. Cuadro resumen de las propiedades de las sustancias 12. Resumen 13. Modelos 3D 14. Prácticas 15. Cuestiones 16. Otros contenidos 17. Vídeos |
1. ESQUEMAS







EnlaceQuímico 1
Enlace químico 2
Enlace químico 3
Enlace químico 4
Enlace químico 5
3. INTRODUCCIÓN
En temas anteriores, ya hemos estudiado el átomo y ahora vamos a ver cómo se pueden combinar esos átomos entre sí. Este aspecto es muy importante ya que, como veremos, según el tipo de enlaces que formen, podremos predecir las propiedades de las sustancias.
Las sustancias están constituidas por agrupaciones de átomos. Unas veces, tales agrupaciones forman agregados neutros: las moléculas y otras resultan con carga: los iones. Sólo los gases nobles y algunos metales en estado vapor están constituidos por moléculas monoatómicas (es decir, por átomos sueltos). La unión entre átomos, iones o moléculas es lo que constituye en enlace químico.
En el enlace químico juega un papel decisivo la configuración electrónica de la capa más externa de los átomos, la de mayor energía, llamada capa de valencia. De esa configuración depende, además, el tipo de enlace que se formará, por ello, y dada su importancia, se utilizan los diagramas de Lewis, en los que figura el símbolo del elemento rodeado de tantos puntos como electrones de valencia posea. Así por ejemplo, los diagramas de Lewis de los elementos del segundo periodo son:
 En la tabla periódica, todos los átomos de un mismo grupo tiene propiedades similares porque todos tienen los mismos electrones de valencia, y un átomo usa algunos o todos los electrones de valencia para combinarse con otros.
En la tabla periódica, todos los átomos de un mismo grupo tiene propiedades similares porque todos tienen los mismos electrones de valencia, y un átomo usa algunos o todos los electrones de valencia para combinarse con otros.
Por otra parte, los gases nobles son muy estables ya que tienen una baja reactividad que se relaciona con su estructura electrónica; todos poseen los orbitales s y p de la última capa completos (a excepción del He). El hecho de que los orbitales de más alta energía de un átomo estén completamente llenos, les da una acusada estabilidad. Esto también se puede comprobar experimentalmente diciendo que tanto el P.I. como la A.E. de los gases nobles son muy altos, (no tienen tendencia ni a coger ni a ceder electrones).
El resto de los átomos, tienden a ganar, perder o compartir electrones con la finalidad de adquirir configuración electrónica de gas noble y ganar así estabilidad. Por ello, los átomos se clasifican según esta tendencia en (además de los gases nobles antes descritos):
Es importante comentar que para que un determinado enlace se forme, tiene que haber necesariamente un desprendimiento de energía, es decir, el compuesto o molécula formada tiene que ser más estable que los átomos de los que se parte, pues de lo contrario no se formará el enlace.
Cuando dos átomos se encuentran infinitamente separados, no hay interacción entre ellos, sin embargo, a medida que se acercan empiezan a aparecer fuerzas de atracción entre el núcleo de uno y la nube electrónica de otro y viceversa con la consiguiente liberación de energía. A una distancia determinada (distancia de enlace), la energía liberada pasa por un mínimo (energía de enlace). Si la distancia de enlace se hace más pequeña, empiezan a aparecer fuerzas de repulsión entre los dos núcleos y las dos nubes electrónicas, tanto más grandes cuanto más cerca estén, para lo cual haría falta aportar energía, tal y como se muestra en la figura (los datos se refieren a la molécula de hidrógeno). Si los átomos nada más empezar a acercarse, generan fuerzas de repulsión, tal y como muestra la segunda figura, nunca formarán un enlace, porque no existe una distancia que estabilice el sistema. Es lo que ocurre al acercar dos átomos de He, por ejemplo.
 ANIMACIONES
ANIMACIONES











4. CARACTERÍSTICAS DEL ENLACE IÓNICO
El enlace iónico es debido a fuerzas de atracción electrostática y no direccional entre iones de signo opuesto producidos por transferencia de electrones entre átomos de elementos de elevada diferencia de electronegatividad.
Como hemos indicado anteriormente, siempre que se forma un enlace, (del tipo que sea), se produce una liberación de energía, es decir, que el nivel de energía de los átomos unidos es menor que el de los átomos por separado.
En el caso de los compuestos iónicos se tiene que formar una red cristalina para que se produzca esa liberación de energía como ahora veremos en un ejemplo. Vamos a analizar la formación de NaCl a partir de los átomos libres de Na y Cl en estado gaseoso:

Para explicar este fenómeno vamos a utilizar la representación electrónica o diagrama de Lewis, según la cual, el símbolo de un átomo representa su núcleo y los electrones de las capas internas, y rodeando a éste se colocan puntos y/o aspas que representan los electrones de la capa de valencia. Los puntos se colocarán por pares si los e‑ están apareados y aislados si no lo están.




ANIMACIONES












4.3. Propiedades de las sustancias iónicas



Fragilidad, pues al golpear ligeramente el cristal produciendo el desplazamiento de tan sólo un átomo, todas las fuerzas que eran atractivas se convierten en repulsivas al enfrentarse dos capas de iones del mismo signo.
Las reacciones de pérdida o ganancia de e– se llaman reacciones de ionización.
Ejemplo de reacciones de ionización:
4.5. Estructura cristalina de los compuestos iónicos
Los iones en los compuestos iónicos se ordenan regularmente en el espacio de la manera más compacta posible. Cada ion se rodea de iones de signo contrario dando lugar a celdas o unidades que se repiten en las tres direcciones del espacio.
Índice de coordinación
“Es el número de iones de signo opuesto que rodean a un ion dado”. Cuanto mayor es un ion con respecto al otro mayor es su índice de coordinación.
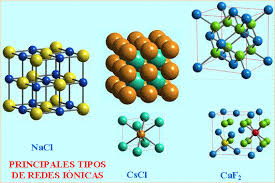
Principales tipos de estructura cristalina

Ejemplo:
5. ENLACE COVALENTE
El enlace iónico se da entre átomos de electronegatividad muy diferente, en cambio, el enlace covalente se da entre elementos de alta electronegatividad muy parecida.
En vez de una cesión de electrones, (como tiene lugar en el enlace iónico), se produce una compartición de pares de e‑, que se concentran entre los núcleos enlazándolos. El número de pares de electrones compartidos será el necesario para que los dos átomos adquieran configuración electrónica de gas noble. A diferencia del enlace iónico, el enlace covalente es direccional y más fuerte; y su formación también comporta una liberación de energía.
ANIMACIONES






5.1. Clasificación de los enlaces covalentes.
5.5.1. atendiendo al número de pares de electrones compartidos:
a) enlace covalente simple: Cada átomo aporta un electrón al enlace, es decir, se comparte un par de electrones entre dos átomos. Un ejemplo es la molécula de Hidrógeno (H2):


La molécula de Hidrógeno presenta una energía menor a la de los átomos separados (que es una condición indispensable para que exista enlace). En este caso los dos átomos de Hidrógeno adquieren configuración electrónica de gas noble.
Otro ejemplo de este tipo de enlace sería la molécula de cloro:
 los dos átomos de cloro tienen 8 electrones a su alrededor y por lo tanto configuración electrónica de gas noble.
los dos átomos de cloro tienen 8 electrones a su alrededor y por lo tanto configuración electrónica de gas noble.
b) enlace covalente doble:
siguiendo con el mismo ejemplo:
 3. Se disponen los enlaces calculados en el apartado a) de todas las formas posibles, con lo que se obtendrán hasta las estructuras resonantes si las hubiera. Después se completan los octetos de los átomos con pares de electrones no enlazantes:
3. Se disponen los enlaces calculados en el apartado a) de todas las formas posibles, con lo que se obtendrán hasta las estructuras resonantes si las hubiera. Después se completan los octetos de los átomos con pares de electrones no enlazantes:
En el caso del dióxido de carbono hay tres posibilidades de colocar 4 enlaces entre los tres átomos:
 4. Se buscan las cargas formales de cada uno de los átomos en las estructuras obtenidas (analizando los electrones que hay alrededor de cada uno de los átomos); y la más estable será la que menos carga formal obtenga.
4. Se buscan las cargas formales de cada uno de los átomos en las estructuras obtenidas (analizando los electrones que hay alrededor de cada uno de los átomos); y la más estable será la que menos carga formal obtenga.
 datos experimentales indican que el dióxido de carbono es una estructura resonante de las tres que hay representadas, teniendo mayor peso específico la del centro.
datos experimentales indican que el dióxido de carbono es una estructura resonante de las tres que hay representadas, teniendo mayor peso específico la del centro.
Veamos otro ejemplo representando la estructura de Lewis del ion nitrato (NO3‑):
1. Cálculo del número de enlaces en la molécula:
 2. Esqueleto de la molécula:
2. Esqueleto de la molécula:
 3 Y 4. Entre paréntesis figuran las cargas formales:
3 Y 4. Entre paréntesis figuran las cargas formales:

datos experimentales demuestran que el ion nitrato es resonante siendo las tres estructuras equivalentes.
Como hemos indicado anteriormente, hay elementos que no cumplen la regla del octeto. Las causas pueden ser:
1a) Monóxido de carbono (CO): el carbono actúa con índice de oxidación +2.
 1b) Monóxido de nitrógeno (NO): Hay un número impar de electrones en la molécula, y el problema se resuelve con la resonancia, dejando el electrón impar en cada uno de los átomos de la molécula:
1b) Monóxido de nitrógeno (NO): Hay un número impar de electrones en la molécula, y el problema se resuelve con la resonancia, dejando el electrón impar en cada uno de los átomos de la molécula:
 1c) Tricloruro de aluminio (AlCl3): En los casos en los que no se cumple la regla del octeto, la ecuación:
1c) Tricloruro de aluminio (AlCl3): En los casos en los que no se cumple la regla del octeto, la ecuación:
 no se puede utilizar, ya que ella implica que cada uno de los átomos se rodea de ocho electrones. Luego, no podemos hacer uso de que en el tricloruro de aluminio hayan 4 enlaces, de hecho, se estructura de Lewis es:
no se puede utilizar, ya que ella implica que cada uno de los átomos se rodea de ocho electrones. Luego, no podemos hacer uso de que en el tricloruro de aluminio hayan 4 enlaces, de hecho, se estructura de Lewis es:
 1d) Pentacloruro de fósforo (PCl5):
1d) Pentacloruro de fósforo (PCl5):
 como vemos, esta ecuación no se puede utilizar ya que en el compuesto al menos se necesitan 5 enlaces. Su estructura de Lewis se obtiene ampliando el octeto del fósforo, ya que, al pertenecer al 3er período tiene orbitales atómicos vacíos ("3d") donde se pueden albergar electrones:
como vemos, esta ecuación no se puede utilizar ya que en el compuesto al menos se necesitan 5 enlaces. Su estructura de Lewis se obtiene ampliando el octeto del fósforo, ya que, al pertenecer al 3er período tiene orbitales atómicos vacíos ("3d") donde se pueden albergar electrones:
 no hay cargas formales ni resonancia.
no hay cargas formales ni resonancia.
1e) Dióxido de azufre (SO2):
 si nos fiamos del resultado de esa ecuación, 3 enlaces, la estructura de Lewis sería:
si nos fiamos del resultado de esa ecuación, 3 enlaces, la estructura de Lewis sería:
 serían dos estructuras resonantes con cargas formales, pero al poderse ampliar el octeto en el átomo de azufre, ya que pertenece al 3er periodo:
serían dos estructuras resonantes con cargas formales, pero al poderse ampliar el octeto en el átomo de azufre, ya que pertenece al 3er periodo:
 y datos experimentales demuestran la existencia de dobles enlaces. Siempre que sea posible eliminar cargas formales ampliando el octeto, se debe hacer.
y datos experimentales demuestran la existencia de dobles enlaces. Siempre que sea posible eliminar cargas formales ampliando el octeto, se debe hacer.
1f) Ácido sulfúrico (H2SO4): Su estructura de Lewis sería:
 para unir todos los átomos, pero, como el azufre pertenece al tercer período puede ampliar el octeto, y sabiendo que al tratarse de un ácido, los hidrógenos deben estar unidos directamente al oxígeno, se puede ver fácilmente que la estructura de Lewis del ácido sulfúrico será:
para unir todos los átomos, pero, como el azufre pertenece al tercer período puede ampliar el octeto, y sabiendo que al tratarse de un ácido, los hidrógenos deben estar unidos directamente al oxígeno, se puede ver fácilmente que la estructura de Lewis del ácido sulfúrico será:


Excepciones a la teoría de lewis
6. ESTRUCTURAS ESPACIALES DE MOLÉCULAS
Una vez realizada la estructura de Lewis de una molécula o ion en el plano, se puede representar su estructura geométrica en el espacio con sólo considerar los pares de electrones enlazantes y no enlazantes que tiene el átomo central de la molécula, teniendo en cuenta que éstos tenderán a separarse el máximo unos de otros, en base a las repulsiones electrostáticas que deben existir. Hay que tener en cuenta que el ángulo de separación entre ellos, también depende del núcleo del átomo al que esté enlazado el átomo central. La tabla de la página 84 nos indica las formas geométricas más corrientes:
Si la molécula posee dobles o triples enlaces, en cuanto a su estructura geométrica, se trata como si fuese un enlace simple.
Como se ha comentado con anterioridad, una molécula covalente será polar, en el caso de que, teniendo enlaces covalentes polares, no posee una simetría, por lo que no se anularan los momentos dipolares de cada uno de sus enlaces y la molécula global tendrá un momento dipolar permanente. Por el contrario, si la molécula posee simetría, se anularán sus momentos dipolares y será apolar. Por ejemplo:
a) Hidruro de berilio (BeH2):
 a pesar de que los enlaces son polares, al ser una molécula lineal y simétrica, será apolar ya que se anulan sus momentos dipolares.
a pesar de que los enlaces son polares, al ser una molécula lineal y simétrica, será apolar ya que se anulan sus momentos dipolares.
Lo mismo le ocurre al metano (CH4) o al tricloruro de aluminio (AlCl3) cuyas estructuras de Lewis ya hemos visto y tienen una estructura espacial tetraédrica y trigonal respectivamente, siendo las dos simétricas y por lo tanto apolares. El elemento más electronegativo es el que se carga negativamente en el dipolo.
b) Amoniaco (NH3): Tiene una estructura espacial de pirámide trigonal que no es simétrica debido al par de electrones antienlazantes que tiene el nitrógeno, y por lo tanto será polar:
C) El agua que también es una molécula polar; tiene una estructura tetraédrica angular que tampoco es simétrica debido a los dos pares de electrones que tiene libres el oxígeno:
A continuación te presentamos una tabla con las estructuras geométricas de moléculas más sencillas y un ejemplo de cada una de ellas. Para deducirlas debes tener en cuenta los siguientes aspectos:
ANIMACIONES


6.1. Modelo de repulsión de pares electrónicos y geometría molecular
Los enlaces covalentes tienen una dirección determinada y las distancias de enlace y los ángulos entre los mismos pueden medirse aplicando técnicas de difracción de rayos X. La geometría viene dada por la repulsión de los pares de e– del átomo central teniendo en cuenta que las parejas de e– se sitúan lo más alejadas posibles.
Según el número y tipo de enlace, así como del número de pares de e– sin compartir podemos clasificar las moléculas en los siguientes grupos:
Según el número de enlaces, éstos se sitúan lo más alejados posibles para evitar lo que se pueda la repulsión entre dichas nubes electrónicas.
Así, si existen dos enlaces con dos átomos, éstos se dirigirán en sentidos contrarios formando quedando los tres átomos alineados, es decir, formando un ángulo de 180º. En el caso de tres enlaces, la manera más alejada de situarse es formando ángulos de 120º estando todos los átomos en el mismo plano. Con cuatro enlaces, éstos se dirigirán hacia los vértices de un tetraedro.
Ejemplos:
BeF2: El Be tiene 2 pares de e– Þ Ang. enl. = 180º.
BCl3: El B tiene 3 pares de e– Þ Ang. enl. = 120º.
CH4: El C tiene 4 pares de e– Þ Ang. enl. = 109,4º.
 6.1.2. El átomo central tiene dos dobles enlaces o uno sencillo y uno triple.
6.1.2. El átomo central tiene dos dobles enlaces o uno sencillo y uno triple.
Como se une únicamente a dos elementos la geometría es lineal, es decir, el ángulo que forma el átomo central con los dos átomos a los que está unido es de 180º.
Ejemplos:
C2H2: Etino (acetileno). Cada C forma un triple enlace y uno sencillo.
CO2: El carbono forma dos dobles enlaces.

6.1.3. El átomo central tiene pares de e– sin compartir.
La repulsión de éstos pares de e– sin compartir es mayor que entre pares de e– de enlace.
Ejemplos:
NH3: El N tiene 3 pares de e– compartidos y 1 sin compartir ------- Ang. enl. = 107’3º < 109’4º
H2O: El O tiene 2 pares de e– compartidos y 2 sin compartir ------- Ang. enl. = 104’5º < 109’4º

6.1.4. El átomo central tiene un enlace doble.
La repulsión debida a 2 pares electrónicos compartidos es mayor que la de uno.
CH2=CH2 (eteno): Cada átomo de carbono tiene 2 pares de e– compartidos con el otro carbono y 2 pares de e– compartidos con sendos átomos de hidrógeno, de manera que:

6.2. Polaridad de las moléculas covalentes. momento dipolar
Las moléculas que tienen enlaces covalentes polares tienen átomos cargados positivamente y otros negativamente.
Cada enlace tiene un momento dipolar “2” (magnitud vectorial que depende la diferencia de “c” entre los átomos cuya dirección es la línea que une ambos átomos y cuyo sentido va del menos electronegativo al más electronegativo).
Dependiendo de cómo sea “ ” de los enlaces que forman una molécula, éstas se clasifican en:
” de los enlaces que forman una molécula, éstas se clasifican en:
6.2.1. Moléculas polares.
Tienen “ ” no nulo. Y esto puede ser debido a:
” no nulo. Y esto puede ser debido a:
Tienen “ ” nulo: Y esto puede ser debido a:
” nulo: Y esto puede ser debido a:

6.3. Teoría del enlace de valencia (TEV).
La mecánica cuántica proporciona una explicación más completa del enlace covalente de lo que lo hace la teoría de Lewis de la compartición de electrones, justificando el papel del par de electrones en la constitución de los enlaces y, al mismo tiempo, describiendo la geometría de las moléculas formadas.
Consideremos la formación de una molécula de hidrógeno (H2). Cuando los dos átomos de Hidrógeno se aproximan, sus núcleos atraen cada vez más a las nubes electrónicas del otro átomo. Llega un momento en que las nubes se solapan parcialmente, con lo que la densidad electrónica entre los núcleos se ve incrementada. Es esta densidad electrónica elevada la que mantiene unidos, por atracción electrostática los dos núcleos, quedando así constituida la molécula.
La formación del enlace H – H, puede expresarse, por tanto, diciendo que se solapan los orbitales 1s de los dos átomos. El solapamiento supone que ambos orbitales comparten una región común del espacio entre los dos núcleos, donde podríamos decir que la probabilidad de encontrar al electrón es máxima.
 Desde el punto de vista energético, cuando los átomos están muy separados, no hay interacción (E=0).
Desde el punto de vista energético, cuando los átomos están muy separados, no hay interacción (E=0).

.png)
Una idea que conviene subrayar es que, para que el proceso sea favorable, los orbitales atómicos que se solapan espacialmente deben poseer electrones desapareados con espines opuestos (para no incumplir el principio de exclusión de Pauli). Esto también explicaría la razón por la que los gases nobles no se unen ni siquiera consigo mismos, ya que no tienen electrones desapareados.
Así pues, la covalencia de un elemento o, el número de enlaces covalentes que podrá formar es igual al número de electrones que posee desapareados. Por ejemplo el flúor tiene una covalencia de 1, el oxígeno de 2.
Algunos elementos tienen más de una covalencia ya que al tener orbitales vacíos pueden desaparear electrones, por ejemplo, el cloro tiene una covalencia de 1, 3, 5 ó 7 porque posee los orbitales “3d” vacíos.

En la teoría de los enlaces de valencia (TEV), los orbitales moleculares se forman por solapamiento de los orbitales atómicos. Para un mejor solapamiento de los orbitales atómicos de partida, estos deben tener tamaño y energías parecidas, así como estructuras espaciales adecuadas. La simetría de los orbitales moleculares formados, depende de los orbitales atómicos que participan en el enlace y de la forma en que se solapan. No vamos a profundizar mucho en el tema, pero comentaremos que existen dos posibilidades:
a) Orbitales moleculares sigma (σ): Los orbitales atómicos se solapan frontalmente y se produce un único solapamiento de las respectivas nubes electrónicas. Tiene un eje de simetría con respecto a la línea que une los dos núcleos. Una rotación con respecto a dicho eje no produce ningún cambio. La máxima probabilidad de encontrar a los electrones en este tipo de orbitales, se concentra entre los dos núcleos fundamentalmente. A continuación te presentamos algunos ejemplos:

b) Orbitales moleculares pi (π): Los orbitales atómicos se solapan lateralmente y se produce dos o más solapamiento de las respectivas nubes electrónicas. Existe un plano nodal de simetría que incluye a los núcleos y la máxima probabilidad de encontrar a los electrones en el orbital molecular formado no se concentra entre los núcleos:

Un orbital molecular es tanto más estable cuanto mayor es el grado de solapamiento entre los orbitales atómicos que lo forman. Los orbitales moleculares sson más estables que los P porque el grado de solapamiento de los orbitales "s" es mayor que el de los "p".

6.4. Teoría de los orbitales moleculares (TOM).
Dentro del marco de la Mecánica cuántica, existe otra teoría que también trata de explicar el enlace covalente. Esta es la teoría de los orbitales moleculares (TOM).
La TOM es una teoría más completa, pero también más difícil de manejar y entender. Estudia la molécula como un conjunto de núcleos y electrones para los cuales hay que resolver la ecuación de Schördinger. De esta manera, se obtienen los orbitales del ámbito de toda la molécula que nos indican, al igual que los orbitales atómicos, la zona del espacio que encierra entre un 90 y un 99% de la probabilidad de encontrar a los electrones de la molécula.
Los orbitales moleculares se forman por combinación de orbitales atómicos. Si esta combinación da lugar a un orbital molecular de menor energía que los dos orbitales atómicos de partida se llama enlazante, y si es de mayor energía antienlazante. En general, los e‑ sólo se disponen en orbitales moleculares antienlazantes cuando la molécula se encuentra en estado excitado, al haber absorbido energía.

ANIMACIONES
6.5. Hibridación de orbitales.
En algunas moléculas se presenta el problema de explicar cómo a partir de orbitales atómicos diferentes se pueden formar enlaces idénticos. Hay que suponer que durante la reacción se produce un proceso de hibridación o recombinación de orbitales atómicos puros, resultando unos nuevos orbitales atómicos híbridos. Dichos orbitales se caracterizan por:

7. ENLACES INTERMOLECULARES
Entre las moléculas covalentes se establecen fuerzas de atracción eléctrica, cuya intensidad depende de la naturaleza de las mismas.
Vamos a diferenciar entre atracciones de dos tipos:
A temperaturas bajas, todos estos compuestos se encuentran en estado sólido formando redes cristalinas muy débiles. La formación de estas redes se explica por las débiles fuerzas de Van der Waals que se originan por atracción electrostática entre dipolos, ya sean permanentes o inducidos. Los de las moléculas apolares son sólidos blandos (como por ejemplo los de yodo), mientras que los de las sustancias polares son algo más duros ya que las fuerzas que unen las moléculas son algo más grandes, por ejemplo en el hielo.
En general tienen puntos de fusión y ebullición muy bajos, y van aumentando en función de la mayor polaridad de las moléculas o del mayor peso molecular, ya que, de esta manera, al ser más fácil crear el dipolo, las uniones serán más fuertes, por ejemplo:
Las sustancias apolares no son conductoras de la corriente eléctrica ya que no poseen partículas cargadas que puedan quedar libres; sin embargo, las polares, al tener dipolos permanentes, pueden conducir, aunque poco, la electricidad.
Dichas sustancias suelen presentarse a temperatura ambiente y presión atmosférica como gases, aunque a medida que las fuerzas intermoleculares aumentan, pueden llegar a ser líquidos e incluso sólidos.
Cabe resaltar, también, que los líquidos covalentes polares, como el agua, tienden a ser muy buenos disolventes de las sustancias iónicas, pero la tendencia de las sustancias moleculares es a disolverse en disolventes apolares.
Son blandos.
Las sustancias polares son solubles en disolventes polares que las estabilizan por fuerzas de atracción dipolo-dipolo y tienen mayores puntos de fusión y ebullición al existir atracción electrostática entre las mismas.
Geometría molecular
Enlace covalente polar
Uniones químicas
8. SÓLIDOS COVALENTES
8.1. Enlaces de las sustancias covalentes.
Las sustancias covalentes son gigantescas agrupaciones de átomos unidos por enlaces covalentes formando sólidos con redes tridimensionales. Dichos átomos deben tener una electronegatividad elevada, junto con la capacidad de tener tres o cuatro electrones enlazantes para formar fuertes enlaces covalentes. Se puede considerar a todo el sólido como una gran molécula.
Ejemplos de estas sustancias son el carbono diamante, el cuarzo (dióxido de silicio), el carburo de Silicio, etc.
8.2. Propiedades de las sustancias covalentes.
Como los átomos están unidos por fuertes enlaces covalentes muy estables, no es de extrañar que:
Una excepción a estas propiedades lo constituye el grafito que forma estructura por capas le hace más blando y al aportar cada átomo de carbono un e– a un macroenlace muy deslocalizado es también conductor.
Todavía hoy no se conoce un modelo que explique de forma convincente como se unen los átomos de los metales. Estudios de rayos X confirman que en la red cristalina existen iones. Sin embargo debe descartarse el modelo de enlace iónico porque ello supondría la transferencia de electrones lo cual no es lógico en átomos iguales. Por otra parte el enlace covalente también queda descartado ya que en este caso los e‑ estarían localizados y los metales no conducirían la electricidad lo que no es cierto.
Para explicar los hechos existen dos teorías: el modelo del gas de electrones y la teoría de bandas que detallamos en los apartados 5.2 y 5.3 respectivamente.
10.1. El modelo del gas de electrones.
Es el modelo más sencillo basado en la intuición más que en conocimientos científicos rigurosos y está sustentado en las siguientes hipótesis:
Los átomos metálicos pierden sus electrones de la capa de valencia quedándose cargados positivamente.
Los cationes forman una red tridimensional ordenada y compacta cuya estructura depende en gran medida del tamaño de los cationes del metal.
Los electrones de valencia liberados ya no pertenecen a cada ión sino a toda la red cristalina, rodeando a los cationes como si fuesen un gas de electrones, neutralizando la carga positiva.
El gas de electrones se mueve libremente dentro de la red cristalina de cationes y no puede escapar de ella debido a la atracción electrostática con los cationes.
ANIMACIONES

12. RESUMEN
13. MODELOS 3D






Moléculas 3D (World of molecules)
Moléculas 3D (G. Gastebois)
Moléculas activas en 3D
14. PRÁCTICAS
Práctica de enlace químico
15. CUESTIONES
Enlace químico 5
3. INTRODUCCIÓN
En temas anteriores, ya hemos estudiado el átomo y ahora vamos a ver cómo se pueden combinar esos átomos entre sí. Este aspecto es muy importante ya que, como veremos, según el tipo de enlaces que formen, podremos predecir las propiedades de las sustancias.
Las sustancias están constituidas por agrupaciones de átomos. Unas veces, tales agrupaciones forman agregados neutros: las moléculas y otras resultan con carga: los iones. Sólo los gases nobles y algunos metales en estado vapor están constituidos por moléculas monoatómicas (es decir, por átomos sueltos). La unión entre átomos, iones o moléculas es lo que constituye en enlace químico.
En el enlace químico juega un papel decisivo la configuración electrónica de la capa más externa de los átomos, la de mayor energía, llamada capa de valencia. De esa configuración depende, además, el tipo de enlace que se formará, por ello, y dada su importancia, se utilizan los diagramas de Lewis, en los que figura el símbolo del elemento rodeado de tantos puntos como electrones de valencia posea. Así por ejemplo, los diagramas de Lewis de los elementos del segundo periodo son:

Por otra parte, los gases nobles son muy estables ya que tienen una baja reactividad que se relaciona con su estructura electrónica; todos poseen los orbitales s y p de la última capa completos (a excepción del He). El hecho de que los orbitales de más alta energía de un átomo estén completamente llenos, les da una acusada estabilidad. Esto también se puede comprobar experimentalmente diciendo que tanto el P.I. como la A.E. de los gases nobles son muy altos, (no tienen tendencia ni a coger ni a ceder electrones).
El resto de los átomos, tienden a ganar, perder o compartir electrones con la finalidad de adquirir configuración electrónica de gas noble y ganar así estabilidad. Por ello, los átomos se clasifican según esta tendencia en (además de los gases nobles antes descritos):
|
En general, se puede decir que cuando un átomo se combina con otro para formar un compuesto, lo hace de tal manera que con ello adquiere la configuración electrónica del gas noble más cercano, (ocho electrones en su última capa, regla del octeto) y eso se puede conseguir a través de una cesión, captación o compartición de e‑. Esta es la razón por la que los gases nobles son tan inertes.Son los electrones más externos, los también llamados electrones de valencia los responsables de esta unión, al igual que de la estequiometría y geometría de las sustancias químicas. Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad.
Hay elementos que no cumplen la regla del octeto, por ejemplo, el H, Li y Be, el número de electrones al que tienden es de dos puesto que el He, (gas noble más cercano), sólo tiene dos; y hay también muchos elementos del tercer período (o superior) que pueden albergar más de ocho electrones en su última capa al poseer orbitales "d" vacíos.

Hay elementos que no cumplen la regla del octeto, por ejemplo, el H, Li y Be, el número de electrones al que tienden es de dos puesto que el He, (gas noble más cercano), sólo tiene dos; y hay también muchos elementos del tercer período (o superior) que pueden albergar más de ocho electrones en su última capa al poseer orbitales "d" vacíos.
3.1. Tipos de enlaces
El enlace covalente se produce por compartición de electrones entre elementos no metálicos o con el hidrógeno, entre átomos de electronegatividades semejante. Se llama covalencia o valencia covalente al número de electrones compartidos por cada elemento en un compuesto covalente, que coincide con el número de electrones desapareados del átomo.
Enlace iónico
El enlace iónico se produce por transferencia de electrones entre un metal, capaz de ceder electrones, y un no metal, capaz de captarlos. Es decir, entre átomos con electronegatividades muy diferentes. Las fuerzas de atracción electrostática entre iones de diferente signo dan lugar al enlace iónico. Se denomina electrovalencia o valencia iónica al número de electrones intercambiados por cada elemento en un enlace iónico.
Enlace metálico
El enlace metálico se produce cuando se unen átomos de un mismo metal, produciéndose estructuras muy compactas formando redes tridimensionales. Las sustancias metálicas tienen propiedades muy características, como el brillo y la conductividad eléctrica, de aquí se deduce que los electrones implicados en este tipo de enlace deben tener gran libertad de movimiento.
Enlaces intermoleculares
Los enlaces intermoleculares se dan entre moléculas, básicamente consisten en interacciones dipolo-dipolo, debidas a la polaridad de las moléculas.
- Iónico (entre iones).
- Covalente (entre átomos de una misma molécula).
- Intermoleculares:
- Fuerzas de Van de Waals
- Enlaces de hidrógeno.
- Metálico (entre cationes metálicos unidos por e–).
El enlace covalente se produce por compartición de electrones entre elementos no metálicos o con el hidrógeno, entre átomos de electronegatividades semejante. Se llama covalencia o valencia covalente al número de electrones compartidos por cada elemento en un compuesto covalente, que coincide con el número de electrones desapareados del átomo.
Enlace iónico
El enlace iónico se produce por transferencia de electrones entre un metal, capaz de ceder electrones, y un no metal, capaz de captarlos. Es decir, entre átomos con electronegatividades muy diferentes. Las fuerzas de atracción electrostática entre iones de diferente signo dan lugar al enlace iónico. Se denomina electrovalencia o valencia iónica al número de electrones intercambiados por cada elemento en un enlace iónico.
Enlace metálico
El enlace metálico se produce cuando se unen átomos de un mismo metal, produciéndose estructuras muy compactas formando redes tridimensionales. Las sustancias metálicas tienen propiedades muy características, como el brillo y la conductividad eléctrica, de aquí se deduce que los electrones implicados en este tipo de enlace deben tener gran libertad de movimiento.
Enlaces intermoleculares
Los enlaces intermoleculares se dan entre moléculas, básicamente consisten en interacciones dipolo-dipolo, debidas a la polaridad de las moléculas.
Es importante comentar que para que un determinado enlace se forme, tiene que haber necesariamente un desprendimiento de energía, es decir, el compuesto o molécula formada tiene que ser más estable que los átomos de los que se parte, pues de lo contrario no se formará el enlace.
Cuando dos átomos se encuentran infinitamente separados, no hay interacción entre ellos, sin embargo, a medida que se acercan empiezan a aparecer fuerzas de atracción entre el núcleo de uno y la nube electrónica de otro y viceversa con la consiguiente liberación de energía. A una distancia determinada (distancia de enlace), la energía liberada pasa por un mínimo (energía de enlace). Si la distancia de enlace se hace más pequeña, empiezan a aparecer fuerzas de repulsión entre los dos núcleos y las dos nubes electrónicas, tanto más grandes cuanto más cerca estén, para lo cual haría falta aportar energía, tal y como se muestra en la figura (los datos se refieren a la molécula de hidrógeno). Si los átomos nada más empezar a acercarse, generan fuerzas de repulsión, tal y como muestra la segunda figura, nunca formarán un enlace, porque no existe una distancia que estabilice el sistema. Es lo que ocurre al acercar dos átomos de He, por ejemplo.





4. CARACTERÍSTICAS DEL ENLACE IÓNICO
El enlace iónico es debido a fuerzas de atracción electrostática y no direccional entre iones de signo opuesto producidos por transferencia de electrones entre átomos de elementos de elevada diferencia de electronegatividad.
Como hemos indicado anteriormente, siempre que se forma un enlace, (del tipo que sea), se produce una liberación de energía, es decir, que el nivel de energía de los átomos unidos es menor que el de los átomos por separado.
En el caso de los compuestos iónicos se tiene que formar una red cristalina para que se produzca esa liberación de energía como ahora veremos en un ejemplo. Vamos a analizar la formación de NaCl a partir de los átomos libres de Na y Cl en estado gaseoso:
Na (g) + Cl2 (g) à Na+ (g) + Cl‑ (g) à ( Na+Cl‑)n (s)
El NaCl es un sólido en el que 6 iones Cl-‑ rodean a un ion Na+ y a su vez cada ion Cl‑ es rodeado por 6 iones Na+ formando una red tridimensional en la que la relación es 1:1, es decir, un ion sodio por cada ion cloro:Para explicar este fenómeno vamos a utilizar la representación electrónica o diagrama de Lewis, según la cual, el símbolo de un átomo representa su núcleo y los electrones de las capas internas, y rodeando a éste se colocan puntos y/o aspas que representan los electrones de la capa de valencia. Los puntos se colocarán por pares si los e‑ están apareados y aislados si no lo están.
Na à Z=11
| 1s2 2s2 2p6 | 3s1 |
Cl à Z=17
| 1s2 2s2 2p6 | 3s2 3p5 |
el átomo de sodio tiene sólo un electrón en su última capa que "tenderá" a perder, quedándose cargado positivamente y, por el contrario, al cloro le falta un electrón para completar su capa, que lo captará del átomo de sodio, incorporándolo al orbital 3p, y así ambos tienen configuración electrónica de gas noble:

| Na | à | Na+ + 1e‑ |
DE = + 496 KJ/mol
|
| Cl + 1e‑ | à | Cl- |
DE = ‑ 348 KJ/mol
|
| Energía necesaria: |
DE = + 148 KJ/mol
| ||
Aunque muchas veces se indique que los metales tienden a perder electrones, este fenómeno es siempre energéticamente desfavorable al igual que la aceptación de electrones por parte de los no metales, (salvo en el caso de algunos halógenos).
Desde el punto de vista energético este proceso es desfavorable ya que hay que aportar 148 KJ/mol, (aporte de energía necesario para que los átomos se ionizaran en estado gaseoso). No obstante, la formación de la red cristalina libera gran cantidad de energía por la atracción electrostática que ahora sufren los iones.
Imaginemos los iones Cl‑ y Na+ infinitamente separados en estado gas y que se van acercando para formar el enlace. En un principio se libera energía por la atracción de los iones, pero cuando éstos están muy cerca, empiezan a tener importancia las repulsiones entre los electrones y entre los núcleos de los iones, por lo tanto existe una distancia interiónica para la que la energía potencial electrostática pasa por un mínimo y, en consecuencia, se libera la máxima energía.
Para los iones de Cloro y Sodio esta distancia es de 2'38 A°, (determinada por difracción de rayos X). Por lo tanto, la energía liberada al acercarse dos iones será:

Sin embargo la formación de la red cristalina libera una cantidad de energía mucho mayor debido a que un ion Cl‑ es atraído por más de un ion Na+ y viceversa. En el caso de NaCl, la energía liberada al pasar de iones gaseosos a la red cristalina, (energía reticular), es de ‑790 KJ/mol (mayor que la calculada para dos iones aislados que era de – 580,4 KJ/mol). En definitiva, la energía necesaria para la ionización (que es de 148 KJ/mol), se ve compensada con la que se libera al formarse el cristal (‑790 KJ/mol).
Todos aquellos elementos cuya energía de ionización se vea compensada suficientemente por la energía reticular, tendrán tendencia a formar este tipo de enlace. Esto ocurre únicamente cuando se combinan elementos muy electronegativos, (anfígenos y halógenos), de alta afinidad electrónica con elementos poco electronegativos, (alcalinos, alcalinotérreos), de bajo potencial de ionización.
Ahora bien, no existe un enlace iónico puro (del 100 %), lo que quiere decir, que no hay una transferencia total de electrones del metal al no metal, habiendo siempre una parte de compartición de éstos entre los dos átomos enlazados.
La mayoría de las sales que provienen de oxoácidos son también de naturaleza iónica; el anión está formado por varios átomos y también forman redes cristalinas. Lo mismo le ocurre al catión amonio.
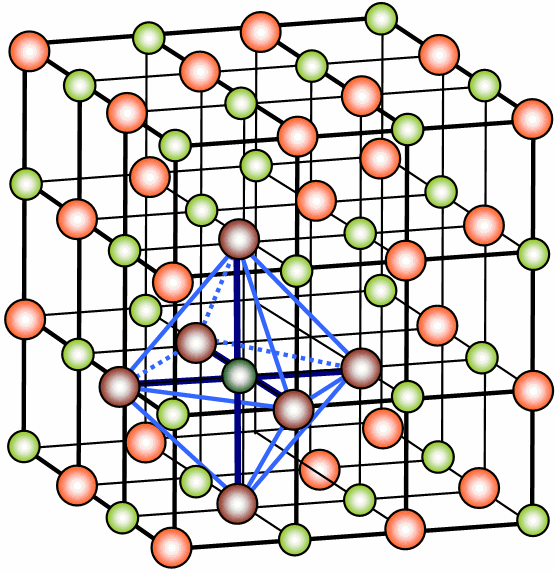
Los sólidos iónicos pueden cristalizar en varios tipos de redes. El que lo haga en un tipo u otro de red depende fundamentalmente del tamaño de los iones que la forman y de la carga que posean. Aquí tienes otras estructuras cristalinas diferentes de compuestos iónicos:













| Agregar Na + iones Añadir Segunda capa Añadir tercera capa Haga clic a través de los elementos anteriores ... |
| Añadir capa de Cs + iones Añadir capa de Cl - iones Añadir otra capa de Cs + iones añadir otra capa de Cl - iones Haga clic a través de los elementos anteriores ... |
4.1. El ciclo de Born-Haber
El cambio energético producido en la formación de un sólido iónico a partir de los elementos que lo constituyen, puede calcularse a partir del llamado ciclo de Born – Haber (que es un caso particular de la ley de Hess). Vamos a seguir con el mismo ejemplo del apartado anterior, es decir, la formación del cloruro sódico (sólido) según la siguiente reacción:
Na (s) + ½ Cl2 (g) à NaCl (s)
La reacción anterior tiene lugar en varios pasos:
El sodio metálico sólido, en primer lugar tendrá que separar sus átomos entre sí. Para ello habrá que aportar la energía de sublimación del Sodio:
| Na (s) + Esublimación | à | Na (g) |
Esublimación = 109 KJ/mol
|
Al sodio gas, habrá que arrancarle un electrón para transformarlo en un ion positivo. Para este proceso necesitaremos aportar la energía de ionización del Sodio:
| Na (g) + Eionización | à | Na + (g) + 1 e- |
Eionización = 496 KJ/mol
|
El Cloro, no metal, en primer lugar tendrá que romper su molécula ya que es diatómico. Para ello tendremos que aportar la mitad de su energía de disociación, ya que por cada molécula que se rompe obtenemos dos átomos de Cloro, por lo tanto sólo habrá que disociar medio mol de moléculas de Cloro para obtener 1 mol de átomos de Cloro.
½ Cl2 (g) + ½ Edisociación à Cl (g)
Posteriormente, tendremos que aportar un electrón a cada átomo de Cloro para transformarlo en un ion negativo. Para ello tendremos que aportar la energía de la afinidad electrónica. Dicha energía suele ser positiva (es decir, hay que aportarla), pero en el caso de algunos halógenos puede llegar a ser negativa (energía desprendida):
| Cl (g) + 1 e- | à | Cl - (g) + Eafinidad |
Eafinidad = -348 KJ/mol
|
Vemos que la energía desprendida no supera a la suministrada; nos faltan 379 KJ/mol. ¿Cómo puede formarse, entonces, el compuesto iónico?. La respuesta está en la energía reticular, que como ya hemos definido antes es la energía desprendida al pasar de los iones en estado gaseoso a la formación de 1 mol de sólido cristalino. En efecto, los iones en estado gaseoso se atraen con perfecto orden en la red y así, es evidente que la energía potencial eléctrica se hace menor.
| Na + (g) + Cl - (g) | à | NaCl (s) + Ereticular |
Ereticular = -790 KJ/mol
|
La energía sobrante será la desprendida en la formación de 1 mol del compuesto iónico:
ΔEf = Esublimación + Eionización + ½ Edisociación + Eafinidad + Ereticular =
= 109 + 496 + 122 – 348 – 790 =
ΔEf = – 411 KJ/mol
A continuación te mostramos un esquema de todo el proceso:

Este sería el diagrama energético del proceso:

Ejemplo
La reacción global de formación de NaCl es:
Na (s) + ½ Cl2 (g) ® NaCl (s) (DHf = –411’1 kJ)
que puede considerarse suma de las siguientes reacciones:
· Na (s) ® Na (g) (DHsubl = +107’8 kJ)
· ½ Cl2 (g) ® Cl (g) (½ DHdis= +121’3 kJ)
· Cl (g) ® Cl– (g) (DHAE = –348’8 kJ)
· Na (g) ® Na+ (g) (DHEI = +495’4 kJ)
· Na+ (g) + Cl– (g) ® NaCl (s) (U = ?)
De donde puede deducirse que:
U = DHf – (DHsubl + ½ DHdis + DHAE + DHEI)
ANIMACIONES

4.2. Factores que influyen en la energía de red
Se han medido los valores de la energía de red de los compuestos iónicos conocidos, y se ha analizado de qué factores depende. Teniendo en cuenta la interacción electrostática entre los iones y el tipo de red (cómo se distribuyen espacialmente los iones), se ha propuesto la ecuación de Born-Landé, que de forma simplificada se puede escribir como:

Donde A es una constante que depende del tipo de red, z+ y z- son los valores absolutos de las cargas de los dos iones de la sustancia (1 y 1 en el NaCl) y r+ y r- sus radios.
4.2.1. Factores que influyen en la energía de red
Fíjate en la expresión de la energía de red. Cuanto mayor sea la carga de los iones, con más fuerza interaccionan entre ellos, y será más difícil destruir la red: mayor será la energía de red.
Si los radios de los iones son menores, están más cerca entre sí, con lo que interaccionan con más fuerza, y la energía de red será más grande.
Fíjate en la siguiente tabla de datos:
 Puedes observar que la energía de red es mayor al aumentar las cargas de los iones y al disminuir su tamaño, que también influyen en que la red iónica sea más compacta y las constante A sea mayor.
Puedes observar que la energía de red es mayor al aumentar las cargas de los iones y al disminuir su tamaño, que también influyen en que la red iónica sea más compacta y las constante A sea mayor.
En la tabla siguiente puedes var las energías de red experimentales de todos los haluros alcalinos.


4.2. Factores que influyen en la energía de red
Se han medido los valores de la energía de red de los compuestos iónicos conocidos, y se ha analizado de qué factores depende. Teniendo en cuenta la interacción electrostática entre los iones y el tipo de red (cómo se distribuyen espacialmente los iones), se ha propuesto la ecuación de Born-Landé, que de forma simplificada se puede escribir como:
4.2.1. Factores que influyen en la energía de red
Fíjate en la expresión de la energía de red. Cuanto mayor sea la carga de los iones, con más fuerza interaccionan entre ellos, y será más difícil destruir la red: mayor será la energía de red.
Si los radios de los iones son menores, están más cerca entre sí, con lo que interaccionan con más fuerza, y la energía de red será más grande.
Fíjate en la siguiente tabla de datos:
En la tabla siguiente puedes var las energías de red experimentales de todos los haluros alcalinos.
No contienen átomos sino iones y puesto que las fuerzas electrostáticas son muy fuertes, tendrán puntos de fusión y de ebullición muy altos.
En estado sólido no conducen la electricidad, ya que los iones tienen posiciones fijas y carecen de movilidad, pero, al fundirse o disolverse en agua, se desmorona la red cristalina quedando los iones en libertad, por lo que estos compuestos fundidos o disueltos conducen la electricidad.
Son sólidos muy duros porque las fuerzas electrostáticas que unen los iones son grandes, pero también son frágiles, ya que, al haber un ordenamiento tan perfecto en la red, pequeños desplazamientos de los iones hacen que las fuerzas que antes eran de atracción pasen a ser de repulsión, por lo que el sólido se rompe:

En general, los sólidos iónicos son solubles en disolventes polares y no en apolares, ya que, las moléculas del disolvente se colocan alrededor de los iones (orientando sus dipolos de forma adecuada), y éstos se separan de la red cristalina.

Hay que tener en cuenta que, no todas las sustancias que en disolución dan iones son sustancias iónicas; también lo hacen algunas sustancias covalentes polares como HCl o H2SO4.
Podemos estudiar la variación de algunas de las propiedades que acabamos de comentar en base a las fuerzas electrostáticas y no direccionales que unen a los iones en la red cristalina. Dichas fuerzas vienen determinadas por la Ley de Coulomb:

por lo tanto, a medida que los iones estén más cargados, y sus radios sean más pequeños, las fuerzas electrostáticas que los unen serán más fuertes, por lo que, tendrán puntos de fusión y ebullición más altos, serán más duros, serán menos solubles, etc. Con los siguientes datos podrás apreciarlo con mayor facilidad:
|
Ejemplo de reacciones de ionización:
· Na – 1 e– ® Na+
· O + 2e– ® O2–
Reac. global: O + 2 Na ® O2– + 2 Na+. Y la formula del compuesto será: Na2O.
También llamada energía de red. Es la energía desprendida en la formación de un mol de compuesto iónico sólido a partir de sus iones en estado gaseoso.
Ejemplo:
En el caso de la formación de NaCl la U o Er corresponde a la reacción:
Na+ (g) + Cl– (g) ® NaCl (s) (U < 0)
Es bastante difícil de calcular por lo que se recurre a métodos indirectos aplicando la ley de Hess. Es lo que se conoce como ciclo de Born y Haber.
Los factores de los que depende la energía reticular (al ser siempre negativa consideraremos siempre valores absolutos) vienen marcados por la ley de Coulumb y son:
· A mayor carga de los iones mayor “U”. Así el CaO (Ca2+ y O2–) tendrá “U” mayor que el NaCl (Na+ y Cl–).
· A menor tamaño de los iones mayor “U”. Así el NaCl (Na+ y Cl–) tendrá “U” mayor que el KBr (K+ y Br–).
Con frecuencia, este tipo de interacción recibe el nombre de puente salino. Son frecuentes entre una enzima y su sustrato, entre los aminoácidos de una proteína o entre los ácidos nucleicos y las proteínas.



Los aminoácidos cargados de una proteína pueden establecer enlaces iónicos (puentes salinos) dentro de una proteína o entre proteínas distintas
La unión de una enzima a su sustrato puede estar gobernada por interacciones electrostáticas.
Los aminoácidos cargados de una proteína pueden establecer enlaces iónicos (puentes salinos) dentro de una proteína o entre proteínas distintas
La unión de una enzima a su sustrato puede estar gobernada por interacciones electrostáticas.
Un ejemplo de esta interacción es la interacción entre el ión Fe++ de la hemoglobina y la molécula de O2, que es apolar. Esta interacción es la que permite la unión reversible del O2 a la hemoglobina y el transporte de O2 desde los pulmones hacia los tejidos .

Los iones en los compuestos iónicos se ordenan regularmente en el espacio de la manera más compacta posible. Cada ion se rodea de iones de signo contrario dando lugar a celdas o unidades que se repiten en las tres direcciones del espacio.
Índice de coordinación
“Es el número de iones de signo opuesto que rodean a un ion dado”. Cuanto mayor es un ion con respecto al otro mayor es su índice de coordinación.
Principales tipos de estructura cristalina
· NaCl (cúbica centrada en las caras para ambos iones). Índice de coordinación para ambos iones es 6.
· CsCl (cúbica para ambos iones). Índice de coordinación para ambos iones = 8
· CaF2 (cúbica centrada en las caras para el Ca2+ y tetraédrica para el F– ).Índice de coordinación para el F– = 4 y para el Ca2+ = 8.
4.5.1. Factores de los que depende la estructura cristalina..
· El tamaño de los iones.
· La estequiometría que viene dada por la carga de los iones de forma que el cristal sea neutro.
Para calcular el nº de átomos por celda se toma una celda unidad y:
Se divide por 8 el nº de iones de los vértices.
Se divide por 4 el nº de iones de las aristas.
Se divide por 2 el nº de iones centrales de las caras.
Se suman todos y se añaden los iones del interior de la celda.
Ejemplo:
Calcular el nº de cationes y aniones que hay en las celdas de NaCl, CsCl y CaF2
NaCl: Cl– : 1 ion en cada vértice (8/8 = 1) + 1 ion en el centro de cada cara (6/2 = 3).
En total, 1 + 3 = 4.
Na+: 1 ion en el centro de cada arista (12/4 = 3) + 1 ion en el centro del cubo (1).
En total, 3 + 1 = 4.
En total, 1 + 3 = 4.
Na+: 1 ion en el centro de cada arista (12/4 = 3) + 1 ion en el centro del cubo (1).
En total, 3 + 1 = 4.
CsCl: Cl– : 1 ion en cada vértice (8/8 = 1). En total, 1.
Cs+ : 1ion en el centro del cubo (1). En total, 1.
Cs+ : 1ion en el centro del cubo (1). En total, 1.
CaF2: Ca2+ : 1 ion en cada vértice (8/8 = 1) + 1 ion en el centro cada cara (6/2 = 3).
En total, 1 + 3 = 4.
F– : 8 iones en el interior de cada celda (8). En total, 8.
Hay por tanto el doble F– que Ca2+ lo que explica su estequiometría.
En total, 1 + 3 = 4.
F– : 8 iones en el interior de cada celda (8). En total, 8.
Hay por tanto el doble F– que Ca2+ lo que explica su estequiometría.
El enlace iónico se da entre átomos de electronegatividad muy diferente, en cambio, el enlace covalente se da entre elementos de alta electronegatividad muy parecida.
En vez de una cesión de electrones, (como tiene lugar en el enlace iónico), se produce una compartición de pares de e‑, que se concentran entre los núcleos enlazándolos. El número de pares de electrones compartidos será el necesario para que los dos átomos adquieran configuración electrónica de gas noble. A diferencia del enlace iónico, el enlace covalente es direccional y más fuerte; y su formación también comporta una liberación de energía.
Se llama energía de enlace a la energía necesaria para romper 1 mol de un determinado tipo de enlace. Es siempre endotérmica (positiva) pues siempre es necesario aportar energía para romper un enlace.
Por ejemplo, para romper 1 mol de H2 (g) en 2 moles de H (g) se precisan 436 kJ, por lo que
La distancia a la que se consigue mayor estabilidad se llama “distancia de enlace”.
Por ejemplo, para romper 1 mol de H2 (g) en 2 moles de H (g) se precisan 436 kJ, por lo que
Eenlace(H–H) = DHdis (H2) = + 436 kJ
ANIMACIONES





5.1. Clasificación de los enlaces covalentes.
5.5.1. atendiendo al número de pares de electrones compartidos:
a) enlace covalente simple: Cada átomo aporta un electrón al enlace, es decir, se comparte un par de electrones entre dos átomos. Un ejemplo es la molécula de Hidrógeno (H2):

Si los átomos están infinitamente separados, se considera que tienen energía cero, pero a medida que se acercan existen fuerzas de atracción

(entre el e‑ de un átomo y el p+ del otro), y fuerzas de repulsión, (entre las dos nubes electrónicas). Al principio las fuerzas de atracción son superiores a las de repulsión por lo que al acercarse se libera energía, pero llega un momento en el que las repulsiones empiezan a tener importancia y cuesta cada vez más acercarlos. Es decir, que la curva pasa por un mínimo y la distancia a la que se produce es la distancia de enlace que para la molécula de H2 es de 0'74 Aº.
La molécula de Hidrógeno presenta una energía menor a la de los átomos separados (que es una condición indispensable para que exista enlace). En este caso los dos átomos de Hidrógeno adquieren configuración electrónica de gas noble.
Otro ejemplo de este tipo de enlace sería la molécula de cloro:

b) enlace covalente doble:
Cada átomo aporta dos electrones al enlace, es decir, se comparten dos pares de electrones entre dos átomos. Un ejemplo es la molécula de Oxígeno (O2):

c) enlace covalente triple:

c) enlace covalente triple:
Cada átomo aporta tres electrones al enlace, es decir, se comparten tres pares de electrones entre dos átomos, por ejemplo, la molécula de Nitrógeno (N2).
 Es conveniente señalar que a medida que se compartan más pares de electrones, la distancia entre los átomos unidos será menor y el enlace será más fuerte (hará falta más energía para romperlo). Esto se puede comprobar con los datos de la siguiente tabla:
Es conveniente señalar que a medida que se compartan más pares de electrones, la distancia entre los átomos unidos será menor y el enlace será más fuerte (hará falta más energía para romperlo). Esto se puede comprobar con los datos de la siguiente tabla:
5.2. Atendiendo a cómo están compartidos los electrones:
5.2.1. Enlace covalente puro o apolar:

| Molécula | Energía (Kcal/mol) | distancia (Aº) |
| F2 (F - F) | 36 | 1,42 |
| O2 (O = O) | 118 | 1,21 |
| N2 (N º N) | 225 | 1,10 |
5.2.1. Enlace covalente puro o apolar:
Los dos átomos que comparten electrones son del mismo elemento o bien de elementos de la misma electronegatividad para que los electrones enlazantes se compartan por igual. Todos los ejemplos vistos hasta ahora son de este tipo.
5.2.2. Enlace covalente polar:
5.2.2. Enlace covalente polar:
En un enlace covalente entre dos átomos iguales, los electrones del enlace se hallan igualmente compartidos, y el caso del enlace iónico constituye el otro extremo en el que los e‑ se transfieren totalmente.
Cuando dos átomos no son iguales, surgen situaciones intermedias en las que los dos e‑ se encuentran compartidos entre los dos átomos pero no por igual. Por ejemplo, en la molécula de HCl el átomo de cloro es más electronegativo, lo que indica que tiene mayor tendencia a atraer la nube electrónica hacia sí que el hidrógeno, con lo que la molécula es eléctricamente asimétrica con más carga negativa concentrada en el átomo de Cl y una cierta carga positiva en el átomo de H; se crea un momento dipolar.
Algunos ejemplos de este tipo de enlaces son:
 al ser el átomo de cloro más electronegativo, atraerá más hacia él los electrones del enlace y se quedará cargado con una fracción de carga negativa.
al ser el átomo de cloro más electronegativo, atraerá más hacia él los electrones del enlace y se quedará cargado con una fracción de carga negativa.
 la diferencia de electronegatividad entre el O y el H explica su elevada polaridad y ésto hace que pueda utilizar como disolvente.
la diferencia de electronegatividad entre el O y el H explica su elevada polaridad y ésto hace que pueda utilizar como disolvente.
 la molécula de amoniaco posee tres enlaces simples polares.
la molécula de amoniaco posee tres enlaces simples polares.
5.2.3. Enlace covalente coordinado o dativo: Es un enlace covalente en el que el par de e‑ que se comparte es aportado por un solo átomo. A los compuestos con este tipo de enlace se llaman complejos. Algunos compuestos con este tipo de enlace son:
‑ El ion amonio; por ejemplo en el cloruro amónico (NH4Cl): es un compuesto iónico, forma redes tridimensionales, (NH4+ Cl‑), donde el catión no es un átomo sino una especie poliatómica en la que sus átomos están unidos por enlaces covalentes, uno de ellos coordinado o dativo:
 uno de los H ha perdido un e‑ y forma con el par de electrones que tiene el N, un enlace covalente coordinado.
uno de los H ha perdido un e‑ y forma con el par de electrones que tiene el N, un enlace covalente coordinado.
‑ El ozono: En el enlace simple, es el átomo central el que aporta los dos electrones del enlace:
 aparecen dos estructuras para el Ozono que se denominan resonantes.
aparecen dos estructuras para el Ozono que se denominan resonantes.
El fenómeno de resonancia surge ante la imposibilidad de poder representar el estado electrónico de una molécula o ion mediante una sola estructura. En estos casos, ninguna de las dos (o más) estructuras resonantes tienen existencia real, sino una hibridación de todas ellas. Por ejemplo, en el caso del ozono, los dos enlaces que forma el átomo central con los de los extremos, son exactamente iguales a pesar de que, en la estructura de Lewis, uno de ellos sea un enlace covalente doble y el otro un enlace covalente coordinado. Este fenómeno de la resonancia es bastante frecuente.
5.3. Estructuras electrónicas o diagramas de Lewis.
No debe confundirse un enlace polar con una molécula polar. Así, por ejemplo, el enlace C‑H es covalente polar, pero la molécula de metano (CH4) es apolar ya que dicha molécula tiene una estructura tetraédrica que, por su simetría, anula todos sus momentos dipolares.


El H2O es la molécula polar más característica. El ángulo que forman los dos enlaces O‑H es de 104'5º debido a la repulsión que ejercen sobre los electrones de los enlaces, dos pares de electrones que posee el oxígeno:
 En definitiva, una molécula con enlaces covalentes apolares, será necesariamente apolar, pero una molécula con enlaces covalentes polares, será apolar si tiene simetría y polar si carece de ella, es decir:
En definitiva, una molécula con enlaces covalentes apolares, será necesariamente apolar, pero una molécula con enlaces covalentes polares, será apolar si tiene simetría y polar si carece de ella, es decir:
 Para ver la estructura espacial de las moléculas y conocer, en definitiva su polaridad, es muy cómodo utilizar las estructuras de Lewis. Aunque ya las hemos utilizado, vamos a profundizar un poco más en ellas.
Para ver la estructura espacial de las moléculas y conocer, en definitiva su polaridad, es muy cómodo utilizar las estructuras de Lewis. Aunque ya las hemos utilizado, vamos a profundizar un poco más en ellas.
Para hallar la estructura de Lewis hay que tener en cuenta que:
1. Se representan las estructuras de Lewis de los elementos de la sustancia a estudiar. Se suman todos los electrones de valencia y se halla el número de enlaces que habrá en la molécula con la siguiente fórmula:

por ejemplo, para el CO2:
 2. Se forma el esqueleto de la molécula, formada por los símbolos de los elementos, poniendo como átomo central el que menos electrones de valencia tenga (exceptuando al hidrógeno) y si hay varios se elige el de mayor volumen (es decir, el de mayor Z).
2. Se forma el esqueleto de la molécula, formada por los símbolos de los elementos, poniendo como átomo central el que menos electrones de valencia tenga (exceptuando al hidrógeno) y si hay varios se elige el de mayor volumen (es decir, el de mayor Z).
Cuando dos átomos no son iguales, surgen situaciones intermedias en las que los dos e‑ se encuentran compartidos entre los dos átomos pero no por igual. Por ejemplo, en la molécula de HCl el átomo de cloro es más electronegativo, lo que indica que tiene mayor tendencia a atraer la nube electrónica hacia sí que el hidrógeno, con lo que la molécula es eléctricamente asimétrica con más carga negativa concentrada en el átomo de Cl y una cierta carga positiva en el átomo de H; se crea un momento dipolar.
Algunos ejemplos de este tipo de enlaces son:
‑ el cloruro de hidrógeno:
‑ el agua:
‑ el amoniaco:
5.2.3. Enlace covalente coordinado o dativo: Es un enlace covalente en el que el par de e‑ que se comparte es aportado por un solo átomo. A los compuestos con este tipo de enlace se llaman complejos. Algunos compuestos con este tipo de enlace son:
‑ El ion amonio; por ejemplo en el cloruro amónico (NH4Cl): es un compuesto iónico, forma redes tridimensionales, (NH4+ Cl‑), donde el catión no es un átomo sino una especie poliatómica en la que sus átomos están unidos por enlaces covalentes, uno de ellos coordinado o dativo:

‑ El ozono: En el enlace simple, es el átomo central el que aporta los dos electrones del enlace:

El fenómeno de resonancia surge ante la imposibilidad de poder representar el estado electrónico de una molécula o ion mediante una sola estructura. En estos casos, ninguna de las dos (o más) estructuras resonantes tienen existencia real, sino una hibridación de todas ellas. Por ejemplo, en el caso del ozono, los dos enlaces que forma el átomo central con los de los extremos, son exactamente iguales a pesar de que, en la estructura de Lewis, uno de ellos sea un enlace covalente doble y el otro un enlace covalente coordinado. Este fenómeno de la resonancia es bastante frecuente.
No debe confundirse un enlace polar con una molécula polar. Así, por ejemplo, el enlace C‑H es covalente polar, pero la molécula de metano (CH4) es apolar ya que dicha molécula tiene una estructura tetraédrica que, por su simetría, anula todos sus momentos dipolares.


Tetraedro Estructura tetraédrica del metano
Para conocer si una molécula es polar o no hay que conocer su estructura espacial.
El H2O es la molécula polar más característica. El ángulo que forman los dos enlaces O‑H es de 104'5º debido a la repulsión que ejercen sobre los electrones de los enlaces, dos pares de electrones que posee el oxígeno:


Para hallar la estructura de Lewis hay que tener en cuenta que:
- El Hidrógeno nunca puede tener más de dos e‑ a su alrededor.
- Los átomos del 2º periodo tienden a cumplir la regla del octeto. No pueden estar rodeados de más de ocho e‑.
- Los demás átomos siguen en general la regla del octeto, pero tienen orbitales "d" vacíos y por lo tanto pueden alojar más de ocho e‑ a su alrededor.
- Cada pareja de e– compartidos forma un enlace.
- Se pueden formar enlaces sencillos, dobles y triples con el mismo átomo.
1. Se representan las estructuras de Lewis de los elementos de la sustancia a estudiar. Se suman todos los electrones de valencia y se halla el número de enlaces que habrá en la molécula con la siguiente fórmula:

por ejemplo, para el CO2:

siguiendo con el mismo ejemplo:

En el caso del dióxido de carbono hay tres posibilidades de colocar 4 enlaces entre los tres átomos:


Veamos otro ejemplo representando la estructura de Lewis del ion nitrato (NO3‑):
1. Cálculo del número de enlaces en la molécula:



datos experimentales demuestran que el ion nitrato es resonante siendo las tres estructuras equivalentes.
Como hemos indicado anteriormente, hay elementos que no cumplen la regla del octeto. Las causas pueden ser:
- Tener pocos electrones de valencia, no llegando a completar el octeto. Así le ocurre al hidrógeno, alcalinos, alcalinotérreos, térreos y carbonoideos con valencia +2.
- Tener muchos electrones de valencia, pudiendo ampliar el octeto al poseer orbitales atómicos vacíos en la capa de valencia.
1a) Monóxido de carbono (CO): el carbono actúa con índice de oxidación +2.






1e) Dióxido de azufre (SO2):



1f) Ácido sulfúrico (H2SO4): Su estructura de Lewis sería:


Ejemplo:
Escribir las estructuras de Lewis completas para las siguientes especies químicas: CH4, HCN, H2CO, Cl2O, NH4+ y H2SO4.
Escribir las estructuras de Lewis completas para las siguientes especies químicas: CH4, HCN, H2CO, Cl2O, NH4+ y H2SO4.

Excepciones a la teoría de lewis
- Moléculas tipo NO y NO2 que tienen un número impar de electrones.
- Moléculas tipo BeCl2 o BF3 con marcado carácter covalente en las cuales el átomo de Be o de B no llegan a tener 8 electrones.
- Moléculas tipo PCl5 o SF6 en las que el átomo central puede tener 5 o 6 enlaces (10 o 12 e–). Sólo puede ocurrir en el caso de que el no-metal no esté en el segundo periodo, pues a partir del tercero existen orbitales “d” y puede haber más de cuatro enlaces.
ANIMACIONES

5.4. Resonancia
En muchas ocasiones, no existe una única estructura de Lewis que pueda explicarlas propiedades de una molécula o ion. Por ejemplo, el ion carbonato CO32– debería tener una estructura en la que el átomo central, el carbono en este caso, formara un doble enlace con uno de los átomos de oxígeno y sendos enlaces sencillos con los átomos de oxígeno que soportan la carga negativa tal y como se ve en dibujo de la izquierda. Sin embargo, esto conllevaría a que las distancias C–O y C=O deberían ser distintas, y tal y como se verá a continuación, los ángulos de enlace, también deberían ser distintos.
Por difracción de rayos X se sabe que las distancias entre el átomo de carbono y cada átomo de oxígeno so iguales, así como los ángulos O–C–O. Para explicar tales datos, se supone que los e– de enlace así como los pares electrónicos sin compartir, pueden desplazarse a lo largo de la molécula o ion, pudiendo formar más de una estructura de Lewis distinta. En el caso del ion CO32–, se podrían formar tres estructuras de Lewis en las que el doble enlace se formara con cada uno de los átomos de oxigeno, siendo las tres válidas. Cada una de estas formas contribuye por igual al la estructura del ion CO32–, siendo la verdadera estructura una mezcla de las tres.

5.4. Resonancia
En muchas ocasiones, no existe una única estructura de Lewis que pueda explicarlas propiedades de una molécula o ion. Por ejemplo, el ion carbonato CO32– debería tener una estructura en la que el átomo central, el carbono en este caso, formara un doble enlace con uno de los átomos de oxígeno y sendos enlaces sencillos con los átomos de oxígeno que soportan la carga negativa tal y como se ve en dibujo de la izquierda. Sin embargo, esto conllevaría a que las distancias C–O y C=O deberían ser distintas, y tal y como se verá a continuación, los ángulos de enlace, también deberían ser distintos.
Por difracción de rayos X se sabe que las distancias entre el átomo de carbono y cada átomo de oxígeno so iguales, así como los ángulos O–C–O. Para explicar tales datos, se supone que los e– de enlace así como los pares electrónicos sin compartir, pueden desplazarse a lo largo de la molécula o ion, pudiendo formar más de una estructura de Lewis distinta. En el caso del ion CO32–, se podrían formar tres estructuras de Lewis en las que el doble enlace se formara con cada uno de los átomos de oxigeno, siendo las tres válidas. Cada una de estas formas contribuye por igual al la estructura del ion CO32–, siendo la verdadera estructura una mezcla de las tres.
Por tanto, los tres enlaces C–O tienen 1/3 de doble enlace, por lo que la distancia es intermedia Igualmente, los tres átomos de oxígeno participar de 2/3 de carga negativa. Además de utilizar el símbolo Ö entre las distintas formas resonantes, también se utiliza una única forma mezcla de todas, en el que aparecen el signo “ ” que indica enlace intermedio entre sencillo y doble y las fracciones de carga con “d”.
” que indica enlace intermedio entre sencillo y doble y las fracciones de carga con “d”.
 ” que indica enlace intermedio entre sencillo y doble y las fracciones de carga con “d”.
” que indica enlace intermedio entre sencillo y doble y las fracciones de carga con “d”.
1. Aromáticos
Benceno
|
Naftaleno
|
2. Catiónicos
Ciclopropenilo
|
Tropilio
|
3. Aniónicos
Acetato
|
Ciclopentadienilo
|
Enolato
|
Acetoacetato
|
4. Neutro dipolar
Diazometano
|
Iluro
|
Nitrometano
|
5. Donante-Aceptor Pares
4-(N,N-dimetilamino)piridina
DMAP |
N,N-dimetil 4-nitroanilina
|
El benceno
es radicalmente diferente: se trata de una molécula plana, con seis átomos que forman un anillo cerrado con ángulos de 120º entre ellos. Además, cada carbono está unido a un hidrógeno (C6H6).
En este caso, la hibridación es sp2 en cada átomo de carbono, al que le queda todavía un orbital atómico p sin hibridar.
¿Cómo se forma el enlace? Se producen seis enlaces sigma entre híbridos sp2 de átomos de dos carbonos, y otros seis enlaces sigma entre hiíbridos sp2 de un átomo de carbono y el orbital 1s de un átomo de hidrógeno. Los orbitales p restantes se solapan lateralmente, dando lugar a tres dobles enlaces alternos.
En este caso, la hibridación es sp2 en cada átomo de carbono, al que le queda todavía un orbital atómico p sin hibridar.
¿Cómo se forma el enlace? Se producen seis enlaces sigma entre híbridos sp2 de átomos de dos carbonos, y otros seis enlaces sigma entre hiíbridos sp2 de un átomo de carbono y el orbital 1s de un átomo de hidrógeno. Los orbitales p restantes se solapan lateralmente, dando lugar a tres dobles enlaces alternos.
Una vez realizada la estructura de Lewis de una molécula o ion en el plano, se puede representar su estructura geométrica en el espacio con sólo considerar los pares de electrones enlazantes y no enlazantes que tiene el átomo central de la molécula, teniendo en cuenta que éstos tenderán a separarse el máximo unos de otros, en base a las repulsiones electrostáticas que deben existir. Hay que tener en cuenta que el ángulo de separación entre ellos, también depende del núcleo del átomo al que esté enlazado el átomo central. La tabla de la página 84 nos indica las formas geométricas más corrientes:
Si la molécula posee dobles o triples enlaces, en cuanto a su estructura geométrica, se trata como si fuese un enlace simple.
Como se ha comentado con anterioridad, una molécula covalente será polar, en el caso de que, teniendo enlaces covalentes polares, no posee una simetría, por lo que no se anularan los momentos dipolares de cada uno de sus enlaces y la molécula global tendrá un momento dipolar permanente. Por el contrario, si la molécula posee simetría, se anularán sus momentos dipolares y será apolar. Por ejemplo:
a) Hidruro de berilio (BeH2):

Lo mismo le ocurre al metano (CH4) o al tricloruro de aluminio (AlCl3) cuyas estructuras de Lewis ya hemos visto y tienen una estructura espacial tetraédrica y trigonal respectivamente, siendo las dos simétricas y por lo tanto apolares. El elemento más electronegativo es el que se carga negativamente en el dipolo.
C) El agua que también es una molécula polar; tiene una estructura tetraédrica angular que tampoco es simétrica debido a los dos pares de electrones que tiene libres el oxígeno:
- El número total de pares de electrones que hay alrededor del átomo central te ayudará a determinar la forma espacial de la molécula.
- Fíjate bien en los pares que son enlazantes y no enlazantes ya que es lo que te permitirá deducir si la molécula es polar o apolar.
- Por otro lado, también hay que tener en cuenta si los átomos a los que se une el átomo central son iguales o no, ya que la diferencia de electronegatividad entre ellos también influirá en la simetría o no de la molécula.
- Recuerda que si existen dobles o triples enlaces, a la hora de establecer la estructura espacial de la molécula contarán como si fuese un solo enlace, sólo que al haber más electrones en una zona concreta, los ángulos con respecto a los enlaces adyacentes serán mayores.
Pares de electrones del átomo central
| Forma geométrica | Ejemplos | |||
| total | enlaz. | no enlaz. | |||
| 2 | 2 | 0 | Hidruro de Berilio Dióxido de carbono | ||
| Lineal | Apolar | ||||
| 3 | 3 | 0 | Borano, Cloruro alumínico | ||
| Triangular plana | Apolar | ||||
| 2 | 1 | Cloruro de estaño, Dióxido de azufre | |||
| Angular trigonal | Polar | ||||
| 4 | 4 | 0 | Metano, Tetrafluoruro de silicio | ||
| Tetraédrica | Apolar | ||||
| 3 | 1 | Amoniaco, Fosfina | |||
| Pirámide trigonal | Polar | ||||
| 2 | 2 | Agua, Sulfuro de hidrógeno | |||
| Angular tetraédrica | Polar | ||||
| 5 | 5 | 0 | Pentacloruro de fósforo | ||
| Bipirámide trigonal | Apolar | ||||
| 4 | 1 | ||||
| Tetraedro irregular o balancín | Polar | ||||
| 3 | 2 | Trifluoruro de cloro | |||
| Forma de T | Polar | ||||
| 6 | 6 | 0 | |||
| Octoédrica | Apolar | ||||
| 5 | 1 | ||||
| Pirámide de base cuadrada | Polar | ||||
| 4 | 2 | ||||
| Cuadrada plana | Apolar | ||||
Molécula
|
Estructura
de Lewis |
Enlaces
|
Pares
solitarios |
Geometría
molecular |
BeCl2
|
2
|
0
|
lineal
| |
BF3
|
3
|
0
|
triangular plana
| |
CH4
|
4
|
0
|
tetraédrica
| |
PCl5
|
5
|
0
|
bipirámide trigonal
| |
SF6
|
6
|
0
|
octaédrica
| |
SnCl2
|
2
|
1
|
angular
| |
NH3
|
3
|
1
|
pirámide trigonal
| |
H2O
|
2
|
2
|
angular
| |
SF4
|
4
|
1
|
tetraedro deformado o balancín
| |
ClF3
|
3
|
2
|
forma de T
| |
I3-
|
2
|
3
|
lineal
| |
BrF5
|
5
|
1
|
pirámide cuadrada
| |
XeF4
|
4
|
2
|
plano-cuadrada
| |
CO2
|
2
|
0
|
lineal
| |
C2H4
|
3
(cada carbono)
|
0
|
triangular plana(en torno de cada carbono)
| |
SOF4
|
5
|
0
|
bipirámide trigonal
| |
XeO2F2
|
4
|
1
|
balancín
|
ANIMACIONES


Los enlaces covalentes tienen una dirección determinada y las distancias de enlace y los ángulos entre los mismos pueden medirse aplicando técnicas de difracción de rayos X. La geometría viene dada por la repulsión de los pares de e– del átomo central teniendo en cuenta que las parejas de e– se sitúan lo más alejadas posibles.
Según el número y tipo de enlace, así como del número de pares de e– sin compartir podemos clasificar las moléculas en los siguientes grupos:
- El átomo central sólo tiene pares de e– de enlace sencillo.
- El átomo central tiene dos dobles enlaces o uno sencillo y uno triple.
- El átomo central tiene pares de e– sin compartir.
- El átomo central tiene un enlace doble.
Según el número de enlaces, éstos se sitúan lo más alejados posibles para evitar lo que se pueda la repulsión entre dichas nubes electrónicas.
Así, si existen dos enlaces con dos átomos, éstos se dirigirán en sentidos contrarios formando quedando los tres átomos alineados, es decir, formando un ángulo de 180º. En el caso de tres enlaces, la manera más alejada de situarse es formando ángulos de 120º estando todos los átomos en el mismo plano. Con cuatro enlaces, éstos se dirigirán hacia los vértices de un tetraedro.
Ejemplos:
BeF2: El Be tiene 2 pares de e– Þ Ang. enl. = 180º.
BCl3: El B tiene 3 pares de e– Þ Ang. enl. = 120º.
CH4: El C tiene 4 pares de e– Þ Ang. enl. = 109,4º.
Como se une únicamente a dos elementos la geometría es lineal, es decir, el ángulo que forma el átomo central con los dos átomos a los que está unido es de 180º.
Ejemplos:
C2H2: Etino (acetileno). Cada C forma un triple enlace y uno sencillo.
CO2: El carbono forma dos dobles enlaces.
6.1.3. El átomo central tiene pares de e– sin compartir.
La repulsión de éstos pares de e– sin compartir es mayor que entre pares de e– de enlace.
Ejemplos:
NH3: El N tiene 3 pares de e– compartidos y 1 sin compartir ------- Ang. enl. = 107’3º < 109’4º
H2O: El O tiene 2 pares de e– compartidos y 2 sin compartir ------- Ang. enl. = 104’5º < 109’4º
6.1.4. El átomo central tiene un enlace doble.
La repulsión debida a 2 pares electrónicos compartidos es mayor que la de uno.
CH2=CH2 (eteno): Cada átomo de carbono tiene 2 pares de e– compartidos con el otro carbono y 2 pares de e– compartidos con sendos átomos de hidrógeno, de manera que:
- Ang. enl. H–C=C: 122º > 120º (triangular)
- Ang. enl. H–C–H: 116º < 120º (triangular)
6.2. Polaridad de las moléculas covalentes. momento dipolar
Las moléculas que tienen enlaces covalentes polares tienen átomos cargados positivamente y otros negativamente.
Cada enlace tiene un momento dipolar “2” (magnitud vectorial que depende la diferencia de “c” entre los átomos cuya dirección es la línea que une ambos átomos y cuyo sentido va del menos electronegativo al más electronegativo).
Dependiendo de cómo sea “
6.2.1. Moléculas polares.
Tienen “
- Moléculas con un sólo enlace covalente polar. Ejemplos: HCl, ClF.
- Moléculas angulares, piramidales… Ejemplos: H2O, NH3.
Tienen “
- Moléculas con enlaces apolares. Ejemplos: H2, Cl2.
- Moléculas con enlaces polares pero con “
” = 0. Ejemplos: CH4, CO2.
Ejemplo
Elemento
|
F
|
O
|
Cl
|
N
|
C
|
S
|
H
|
Electronegat.
|
4,0
|
3,5
|
3,0
|
3,0
|
2,5
|
2,5
|
2,1
|
a) Ordene según la polaridad creciente, basándote en los valores de electronegatividades de la tabla adjunta, los enlaces siguientes: H–F, H–O, H–N, H–C, C–O y C–Cl. b) la polaridad de la molécula de CH4 ¿será igual o distinta de la de CCl4?
a) H–C < C–Cl < H–N < C–O < H–O < H–F
b) El CH4 es globalmente apolar (m = 0) pues la suma vectorial de los dipolos de cada enlace (dirigidos hacia el centro) se anula debido a sus geometría tetraédrica. El CCl4 es igualmente apolar por la misma razón; sin embargo los dipolos de los enlaces están en esta ocasión dirigidos hacia fuera.
6.3. Teoría del enlace de valencia (TEV).
La mecánica cuántica proporciona una explicación más completa del enlace covalente de lo que lo hace la teoría de Lewis de la compartición de electrones, justificando el papel del par de electrones en la constitución de los enlaces y, al mismo tiempo, describiendo la geometría de las moléculas formadas.
Consideremos la formación de una molécula de hidrógeno (H2). Cuando los dos átomos de Hidrógeno se aproximan, sus núcleos atraen cada vez más a las nubes electrónicas del otro átomo. Llega un momento en que las nubes se solapan parcialmente, con lo que la densidad electrónica entre los núcleos se ve incrementada. Es esta densidad electrónica elevada la que mantiene unidos, por atracción electrostática los dos núcleos, quedando así constituida la molécula.
La formación del enlace H – H, puede expresarse, por tanto, diciendo que se solapan los orbitales 1s de los dos átomos. El solapamiento supone que ambos orbitales comparten una región común del espacio entre los dos núcleos, donde podríamos decir que la probabilidad de encontrar al electrón es máxima.


.png)
Al aproximarse, comienza el solapamiento de los orbitales 1s y la fuerza de atracción entre los átomos se incrementa, con lo que la energía potencial del sistema disminuye y llega a alcanzar un mínimo. En este momento, el solapamiento es el óptimo y la distancia entre los núcleos es precisamente la longitud del enlace H – H de la molécula H2. Si a partir de este momento, seguimos acercando los átomos, la energía potencial aumenta debido a la repulsión ejercida por los dos núcleos de los dos átomos.
Una idea que conviene subrayar es que, para que el proceso sea favorable, los orbitales atómicos que se solapan espacialmente deben poseer electrones desapareados con espines opuestos (para no incumplir el principio de exclusión de Pauli). Esto también explicaría la razón por la que los gases nobles no se unen ni siquiera consigo mismos, ya que no tienen electrones desapareados.
Así pues, la covalencia de un elemento o, el número de enlaces covalentes que podrá formar es igual al número de electrones que posee desapareados. Por ejemplo el flúor tiene una covalencia de 1, el oxígeno de 2.
Algunos elementos tienen más de una covalencia ya que al tener orbitales vacíos pueden desaparear electrones, por ejemplo, el cloro tiene una covalencia de 1, 3, 5 ó 7 porque posee los orbitales “3d” vacíos.

En la teoría de los enlaces de valencia (TEV), los orbitales moleculares se forman por solapamiento de los orbitales atómicos. Para un mejor solapamiento de los orbitales atómicos de partida, estos deben tener tamaño y energías parecidas, así como estructuras espaciales adecuadas. La simetría de los orbitales moleculares formados, depende de los orbitales atómicos que participan en el enlace y de la forma en que se solapan. No vamos a profundizar mucho en el tema, pero comentaremos que existen dos posibilidades:
a) Orbitales moleculares sigma (σ): Los orbitales atómicos se solapan frontalmente y se produce un único solapamiento de las respectivas nubes electrónicas. Tiene un eje de simetría con respecto a la línea que une los dos núcleos. Una rotación con respecto a dicho eje no produce ningún cambio. La máxima probabilidad de encontrar a los electrones en este tipo de orbitales, se concentra entre los dos núcleos fundamentalmente. A continuación te presentamos algunos ejemplos:

b) Orbitales moleculares pi (π): Los orbitales atómicos se solapan lateralmente y se produce dos o más solapamiento de las respectivas nubes electrónicas. Existe un plano nodal de simetría que incluye a los núcleos y la máxima probabilidad de encontrar a los electrones en el orbital molecular formado no se concentra entre los núcleos:

Un orbital molecular es tanto más estable cuanto mayor es el grado de solapamiento entre los orbitales atómicos que lo forman. Los orbitales moleculares sson más estables que los P porque el grado de solapamiento de los orbitales "s" es mayor que el de los "p".
6.4. Teoría de los orbitales moleculares (TOM).
Dentro del marco de la Mecánica cuántica, existe otra teoría que también trata de explicar el enlace covalente. Esta es la teoría de los orbitales moleculares (TOM).
La TOM es una teoría más completa, pero también más difícil de manejar y entender. Estudia la molécula como un conjunto de núcleos y electrones para los cuales hay que resolver la ecuación de Schördinger. De esta manera, se obtienen los orbitales del ámbito de toda la molécula que nos indican, al igual que los orbitales atómicos, la zona del espacio que encierra entre un 90 y un 99% de la probabilidad de encontrar a los electrones de la molécula.
Los orbitales moleculares se forman por combinación de orbitales atómicos. Si esta combinación da lugar a un orbital molecular de menor energía que los dos orbitales atómicos de partida se llama enlazante, y si es de mayor energía antienlazante. En general, los e‑ sólo se disponen en orbitales moleculares antienlazantes cuando la molécula se encuentra en estado excitado, al haber absorbido energía.

FORMACIÓN DE ORBITALES MOLECULARES
|
DISTRIBUCIÓN ENERGÉTICA DE LOS ORBITALES MOLECULARES
|
|---|---|
HIDRÓGENO H2
| |
BORO B2
|
ANIMACIONES
En algunas moléculas se presenta el problema de explicar cómo a partir de orbitales atómicos diferentes se pueden formar enlaces idénticos. Hay que suponer que durante la reacción se produce un proceso de hibridación o recombinación de orbitales atómicos puros, resultando unos nuevos orbitales atómicos híbridos. Dichos orbitales se caracterizan por:
- Se produce el mismo número de orbitales híbridos que orbitales atómicos de partida.
- Son todos iguales, energéticamente y formalmente. Sólo se diferencian en su orientación espacial.
- Para que pueda existir hibridación, la energía de los orbitales atómicos de partida debe ser muy similar.
- Los ángulos entre ellos son iguales.
6.5.1. Tipos de hibridación
Los principales tipos de hibridación son los siguientes:
Hibridación sp3. Se hibridan un orbital “s” y tres orbitales “p”. Se forman cuatro orbitales con orientación dirigida hacia los vértices de un tetraedro.

Los principales tipos de hibridación son los siguientes:
Hibridación sp3. Se hibridan un orbital “s” y tres orbitales “p”. Se forman cuatro orbitales con orientación dirigida hacia los vértices de un tetraedro.
- 4 enlaces sencillos. Ejemplo: metano
- 3 enlaces sencillos + 1 par e– sin compartir. Ejemplo: NH3
- 2 enlaces sencillos + 2 par e– sin compartir. Ejemplo: H2O
- 3 enlaces sencillos. Ejemplo: BF3
- 1 enlace doble y 2 sencillos. Ejemplo: eteno
- 2 enlaces sencillos. Ejemplo: BeF2
- 2 enlaces dobles. Ejemplo: CO2
- 1 enlace triple y 1 sencillo. Ejemplo: etino
Vamos a ver algunos ejemplos:
a) Hidruro de berilio (BeH2); hibridación sp:
El Berilio tiene de número atómico Z = 4 y su estructura electrónica es:
 con lo que al no tener electrones desapareados, no podría formar enlaces covalentes. Sin embargo, con un poco de energía, adquiere la siguiente configuración:
con lo que al no tener electrones desapareados, no podría formar enlaces covalentes. Sin embargo, con un poco de energía, adquiere la siguiente configuración:
 ya que al tener los orbitales atómicos 2s y 2p energías muy parecidas, resulta fácil que un electrón de los situados en el orbital 2s pase a ocupar un orbital 2p vacío evitando así la repulsión que podría existir al haber dos electrones en el mismo orbital 2s. De esta manera, al tener dos electrones desapareados podría formar dos enlaces covalentes.
ya que al tener los orbitales atómicos 2s y 2p energías muy parecidas, resulta fácil que un electrón de los situados en el orbital 2s pase a ocupar un orbital 2p vacío evitando así la repulsión que podría existir al haber dos electrones en el mismo orbital 2s. De esta manera, al tener dos electrones desapareados podría formar dos enlaces covalentes.
Al unirse con el hidrógeno, se puede pensar que el estar los dos electrones en orbitales atómicos distintos (en energía, forma, tamaño y orientación), los enlaces sean distintos, pero experimentalmente se comprueba que los dos enlaces son idénticos. Esto se explica diciendo que ha habido una homogeneización de un orbital s y otro p (hibridación sp). Se forman dos orbitales híbridos sp:
 La molécula de hidruro de berilio es lineal.
La molécula de hidruro de berilio es lineal.

b) Borano (BH3); hibridación sp2 :
El Boro tiene de número atómico Z = 5 y su estructura electrónica es:
 al tener un electrón desapareado, sólo podría formar un enlace. Sin embargo, por la misma razón que en el caso anterior, con un poco de energía, adquiere la siguiente configuración:
al tener un electrón desapareado, sólo podría formar un enlace. Sin embargo, por la misma razón que en el caso anterior, con un poco de energía, adquiere la siguiente configuración:
 Así, al tener tres electrones desapareados puede formar tres enlaces covalentes. Pero, al igual que antes los tres enlaces son iguales a pesar de que los orbitales atómicos en los que están los electrones a compartir son distintos. En este caso se produce una homogeneización de un orbital s y dos p (hibridación sp2). Se producen tres orbitales híbridos sp2:
Así, al tener tres electrones desapareados puede formar tres enlaces covalentes. Pero, al igual que antes los tres enlaces son iguales a pesar de que los orbitales atómicos en los que están los electrones a compartir son distintos. En este caso se produce una homogeneización de un orbital s y dos p (hibridación sp2). Se producen tres orbitales híbridos sp2:
 La molécula de trihidruro de boro o borano es trigonal, cada enlace está separado del otro formando un ángulo de 120 º:
La molécula de trihidruro de boro o borano es trigonal, cada enlace está separado del otro formando un ángulo de 120 º:

c) Metano (CH4); hibridación sp3 :
El Carbono tiene de número atómico Z = 6 y su estructura electrónica es:
 tiene dos electrones desapareados y puede formar dos enlaces. Así es su configuración cuando actúa con valencia 2. Pero la mayoría de los compuestos del carbono tienen lugar cuando éste actúa con valencia 4, adquiriendo la siguiente configuración:
tiene dos electrones desapareados y puede formar dos enlaces. Así es su configuración cuando actúa con valencia 2. Pero la mayoría de los compuestos del carbono tienen lugar cuando éste actúa con valencia 4, adquiriendo la siguiente configuración:
 Así, al tener cuatro electrones desapareados puede formar cuatro enlaces covalentes. Experimentalmente, también se ha comprobado que los cuatro enlaces son iguales, produciéndose una homogeneización de un orbital s y tres p (hibridación sp3). Se producen cuatro orbitales híbridos sp3:
Así, al tener cuatro electrones desapareados puede formar cuatro enlaces covalentes. Experimentalmente, también se ha comprobado que los cuatro enlaces son iguales, produciéndose una homogeneización de un orbital s y tres p (hibridación sp3). Se producen cuatro orbitales híbridos sp3:
 La molécula de tretrahidruro de carbono o metano es tretragonal.
La molécula de tretrahidruro de carbono o metano es tretragonal.


d) Hexafluoruro de azufre (SF6); hibridación sp3d2 :
El Azufre tiene de número atómico Z = 16 y su estructura electrónica es:
 tiene dos electrones desapareados y puede formar dos enlaces. Así es su configuración cuando actúa con valencia 2. Pero, al tener los orbitales 3d una energía similar a la de los 3s y 3p, con un poco más de energía, desaparea todos sus electrones adquiriendo la configuración:
tiene dos electrones desapareados y puede formar dos enlaces. Así es su configuración cuando actúa con valencia 2. Pero, al tener los orbitales 3d una energía similar a la de los 3s y 3p, con un poco más de energía, desaparea todos sus electrones adquiriendo la configuración:
 Los seis enlaces que puede formar son iguales, produciéndose una homogeneización de un orbital s, tres p y dos d, es decir, se forman seis orbitales híbridos sp3d2:
Los seis enlaces que puede formar son iguales, produciéndose una homogeneización de un orbital s, tres p y dos d, es decir, se forman seis orbitales híbridos sp3d2:
 La molécula de hexafluoruro de azufre tiene una estructura espacial octoédrica.
La molécula de hexafluoruro de azufre tiene una estructura espacial octoédrica.







 ANIMACIONES
ANIMACIONES
a) Hidruro de berilio (BeH2); hibridación sp:
El Berilio tiene de número atómico Z = 4 y su estructura electrónica es:


Al unirse con el hidrógeno, se puede pensar que el estar los dos electrones en orbitales atómicos distintos (en energía, forma, tamaño y orientación), los enlaces sean distintos, pero experimentalmente se comprueba que los dos enlaces son idénticos. Esto se explica diciendo que ha habido una homogeneización de un orbital s y otro p (hibridación sp). Se forman dos orbitales híbridos sp:


b) Borano (BH3); hibridación sp2 :
El Boro tiene de número atómico Z = 5 y su estructura electrónica es:




c) Metano (CH4); hibridación sp3 :
El Carbono tiene de número atómico Z = 6 y su estructura electrónica es:





d) Hexafluoruro de azufre (SF6); hibridación sp3d2 :
El Azufre tiene de número atómico Z = 16 y su estructura electrónica es:





e) Otros ejemplos







7. ENLACES INTERMOLECULARES
- Fuerzas de atracción entre dipolos.
- Enlaces por puente de hidrógeno.
Fueron postuladas por Van der Waals en 1873, y a pesar de que son mil veces menores que un enlace covalente, sin ellas no se podría explicar la licuación de determinados gases formados por moléculas no polares.
Son fuerzas débiles de atracción entre dipolos que pueden ser inducidos (Fuerzas de London) o permanentes (Fuerzas de Van der Waals).
7.1.1. Fuerzas de London:
Son fuerzas débiles de atracción entre dipolos que pueden ser inducidos (Fuerzas de London) o permanentes (Fuerzas de Van der Waals).
7.1.1. Fuerzas de London:
Se producen entre sustancias no polares como el N2, O2, etc. e incluso entre átomos: He, Ne, etc. Si bajamos mucho la temperatura, los electrones de dichas sustancias pierden energía cinética, y entonces, es posible, que en un instante determinado exista más densidad de carga electrónica en un extremo de la molécula que en otro, creándose un dipolo inducido. Si ésto ocurre en moléculas (o átomos) contiguos, puede hacer que se atraigan formando uniones entre ellas, pudiéndose llegar a la licuación de dichos gases. A medida que el átomo o la molécula sea más grande, este dipolo inducido será más fácil de crear.
7.1.2. Fuerzas de Van der Waals:
Las fuerzas de dispersión son fuerzas atractivas débiles que se establecen fundamentalmente entre sustancias no polares, aunque también están presentes en las sustancias polares. Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua. La formación de un dipolo instantáneo en una molécula origina la formación de undipolo inducido en una molécula vecina de manera que se origina una débil fuerza de atracción entre las dos (ver tabla inferior).
Estas fuerzas son mayores al aumentar el tamaño y la asimetría de las moléculas. Son mínimas en los gases nobles (He, Ne), algo mayores en los gases diatómicos (H2, N2, O2) y mayores aún en los gases poliatómicos (O3, CO2). | ||||||||
Cuando se encuentran a una distancia moderada, las moléculas se atraen entre sí pero, cuando sus nubes electrónicas empiezan a solaparse, las moléculas se repelen con fuerza.

El término "fuerzas de van der Waals" engloba colectivamente a las fuerzas de atracción entre las moléculas. Son fuerzas de atracción débiles que se establecen entre moléculas eléctricamente neutras (tanto polares como no polares), pero son muy numerosas y desempeñan un papel fundamental en multitud de procesos biológicos.
Si las moléculas ya son polares, los dipolos se orientan para atraerse con el polo de signo contrario de la molécula vecina, existiendo fuerzas de atracción entre ellas. Aunque estas fuerzas siguen siendo débiles, son mayores que las de London, en las que el dipolo tiene que ser inducido.
7.2. Enlaces por puente de hidrógeno:
El término "fuerzas de van der Waals" engloba colectivamente a las fuerzas de atracción entre las moléculas. Son fuerzas de atracción débiles que se establecen entre moléculas eléctricamente neutras (tanto polares como no polares), pero son muy numerosas y desempeñan un papel fundamental en multitud de procesos biológicos.
Si las moléculas ya son polares, los dipolos se orientan para atraerse con el polo de signo contrario de la molécula vecina, existiendo fuerzas de atracción entre ellas. Aunque estas fuerzas siguen siendo débiles, son mayores que las de London, en las que el dipolo tiene que ser inducido.
7.2. Enlaces por puente de hidrógeno:
Para que se produzca un enlace de este tipo, deben cumplirse dos condiciones:
- El hidrógeno se une a un elemento muy electronegativo (F, Cl, O o N), con lo que, al ser la diferencia de electronegatividad elevada, se forma un enlace covalente muy polar, donde el hidrógeno es el que se carga positivamente.
- El elemento al que se une el hidrógeno debe tener pares de electrones que no formen parte del enlace covalente polar con el hidrógeno.
- La molécula debe ser polar, es decir, debe carecer de simetría que anule los dipolos creados.
- dipolos de moléculas contiguas, es decir, el polo positivo de una molécula con el negativo de otra.
- el polo positivo del dipolo de una molécula con los pares de electrones no enlazantes del elemento al que se une el hidrógeno, de otra molécula.
Los puentes de hidrógeno constituyen un caso especial de interacción dipolo-dipolo (Figura de la derecha). Se producen cuando un átomo de hidrógeno está unido covalentemente a un elemento que sea:



Estas condiciones se cumplen en el caso de losátomos de F, O y N.
El enlace que forman con el hidrógeno es muy polar y el átomo de hidrógeno es un centro de cargas positivas que será atraído hacia los pares de electrones sin compartir de los átomos electronegativos de otras moléculas (Figura de la izquierda). Se trata de un enlace débil (entre 2 y 10 Kcal/mol). Sin embargo, como son muy abundantes, su contribución a la cohesión entre biomoléculas es grande.
La distancia entre los átomos electronegativos unidos mediante un puente de hidrógeno suele ser de unos 3 Å. El hidrógeno se sitúa a 1Å del átomo al que está covalentemente unido y a 2 Å del que cede sus e- no apareados (Figura de la derecha).
Muchas de las propiedades físicas y químicas del agua se deben a los puentes de hidrógeno. Cada molécula de agua es capaz de dormar 4 puentes de hidrógeno, lo que explica su elevado punto de abullición, ya que es necesario romper gran cantidad de puentes de hidrógeno para que una molécula de agua pase al estado gaseoso.


Este enlace es fundamental en bioquímica, ya que:
condiciona en gran medida la estructura espacial de las proteínas y de los ácidos nucleicos y
está presente en gran parte de las interacciones que tienen lugar entre distintos tipos de biomoléculasen multitud de procesos fundamentales para los seres vivos:
- muy electronegativo y con dobletes electrónicos sin compartir
- de muy pequeño tamaño y capaz, por tanto, de aproximarse al núcleo del hidrógeno
Estas condiciones se cumplen en el caso de losátomos de F, O y N.
El enlace que forman con el hidrógeno es muy polar y el átomo de hidrógeno es un centro de cargas positivas que será atraído hacia los pares de electrones sin compartir de los átomos electronegativos de otras moléculas (Figura de la izquierda). Se trata de un enlace débil (entre 2 y 10 Kcal/mol). Sin embargo, como son muy abundantes, su contribución a la cohesión entre biomoléculas es grande.
La distancia entre los átomos electronegativos unidos mediante un puente de hidrógeno suele ser de unos 3 Å. El hidrógeno se sitúa a 1Å del átomo al que está covalentemente unido y a 2 Å del que cede sus e- no apareados (Figura de la derecha).
Muchas de las propiedades físicas y químicas del agua se deben a los puentes de hidrógeno. Cada molécula de agua es capaz de dormar 4 puentes de hidrógeno, lo que explica su elevado punto de abullición, ya que es necesario romper gran cantidad de puentes de hidrógeno para que una molécula de agua pase al estado gaseoso.
Este enlace es fundamental en bioquímica, ya que:
condiciona en gran medida la estructura espacial de las proteínas y de los ácidos nucleicos y
está presente en gran parte de las interacciones que tienen lugar entre distintos tipos de biomoléculasen multitud de procesos fundamentales para los seres vivos:
- En las hélices a de las proteínas se forman puentes de hidrógeno (en color verde) entre los enlaces peptídicos de aminoácidos que distan 4 posiciones en la secuencia
- Las dos hebras del DNA se mantienen unidas mediante los puentes de hidrógeno que se forman entre las bases nitrogenadas
Este es el llamado enlace por puente de hidrógeno que es mucho más fuerte que las fuerzas de Van der Waals.
Hay que señalar también que los enlaces por puente de hidrógeno se pueden dar entre moléculas diferentes (intermoleculares) o dentro de una misma molécula si su geometría es la adecuada (intramoleculares).
Es importante que se entienda que tanto las fuerzas de Van der Waals como los enlaces por puente de hidrógeno son mucho más débiles que los enlaces covalentes, y de hecho, cuando calentamos una sustancia covalente, se rompen de forma relativamente fácil los enlaces intermoleculares pero nunca los enlaces covalentes que unen a los distintos átomos de la molécula. Por ejemplo, cuando hervimos agua, no obtenemos hidrógeno y oxígeno sino vapor de agua, es decir, se han roto los enlaces por puente de hidrógeno pero no los enlaces covalentes que unen a los átomos de hidrógeno con el de oxígeno.
Hay que señalar también que los enlaces por puente de hidrógeno se pueden dar entre moléculas diferentes (intermoleculares) o dentro de una misma molécula si su geometría es la adecuada (intramoleculares).
Es importante que se entienda que tanto las fuerzas de Van der Waals como los enlaces por puente de hidrógeno son mucho más débiles que los enlaces covalentes, y de hecho, cuando calentamos una sustancia covalente, se rompen de forma relativamente fácil los enlaces intermoleculares pero nunca los enlaces covalentes que unen a los distintos átomos de la molécula. Por ejemplo, cuando hervimos agua, no obtenemos hidrógeno y oxígeno sino vapor de agua, es decir, se han roto los enlaces por puente de hidrógeno pero no los enlaces covalentes que unen a los átomos de hidrógeno con el de oxígeno.
7.3. Otros tipos de enlaces
7.3.1. Interacciones hidrofóbicas
En un medio acuoso, las moléculas hidrofóbicas tienden a asociarse por el simple hecho de que evitan interaccionar con el agua. Lo hace por razones termodinámicas: las moléculas hidrofóbicas se asocian parainimizar el número de moléculas de agua que puedan estar en contacto con las moléculas hidrofóbicas (ver tabla inferior).
7.4. Propiedades de las sustancias moleculares.7.3.1. Interacciones hidrofóbicas
En un medio acuoso, las moléculas hidrofóbicas tienden a asociarse por el simple hecho de que evitan interaccionar con el agua. Lo hace por razones termodinámicas: las moléculas hidrofóbicas se asocian parainimizar el número de moléculas de agua que puedan estar en contacto con las moléculas hidrofóbicas (ver tabla inferior).
Este fenómeno se denomina efecto hidrofóbico y es el responsable de que determinados lípidos formen agregados supramoleculares. Son ejemplos de fuerzas hidrofóbicas: las que se establecen entre los fosfolípidos que forman las membranas celulares (forman bicapas) las que se establecen en el interior de una micela durante la digestión de los lípidos las que hacen que los aminoácidos hidrofóbicos se apiñen en el interior de las proteínas globulares La membrana celular es una bicapa lipídica Micela formada por moléculas anfipáticas Apiñamiento de aminoácidos apolares (azul) en el interior de una proteína globular4.9. Fuerzas 7.3.2. dipolo-dipolo inducido Tienen lugar entre una molécula polar y una molécula apolar. En este caso, la carga de una molécula polar provoca una distorsión en la nube electrónica de la molécula apolar y la convierte, de modo transitorio, en un dipolo. En este momento se establece una fuerza de atracción entre las moléculas. Gracias a esta interacción, gases apolares como el O2, el N2 o el CO2 se pueden disolver en agua. |
A temperaturas bajas, todos estos compuestos se encuentran en estado sólido formando redes cristalinas muy débiles. La formación de estas redes se explica por las débiles fuerzas de Van der Waals que se originan por atracción electrostática entre dipolos, ya sean permanentes o inducidos. Los de las moléculas apolares son sólidos blandos (como por ejemplo los de yodo), mientras que los de las sustancias polares son algo más duros ya que las fuerzas que unen las moléculas son algo más grandes, por ejemplo en el hielo.
En general tienen puntos de fusión y ebullición muy bajos, y van aumentando en función de la mayor polaridad de las moléculas o del mayor peso molecular, ya que, de esta manera, al ser más fácil crear el dipolo, las uniones serán más fuertes, por ejemplo:
| Sustancia | Tfusión (ºC) | Mr (umas) | Momento dipolar (D) |
| H2O | 100 | 18 | 1’85 |
| CH4 | - 164 | 16 | 0 |
| CH3 - CH3 | - 89 | 30 | 0 |
| CH3 - CH2 - CH3 | - 42 | 44 | 0’084 |
| CH3 - CH2 - OH | 78’5 | 46 | 1,69 |
Dichas sustancias suelen presentarse a temperatura ambiente y presión atmosférica como gases, aunque a medida que las fuerzas intermoleculares aumentan, pueden llegar a ser líquidos e incluso sólidos.
Cabe resaltar, también, que los líquidos covalentes polares, como el agua, tienden a ser muy buenos disolventes de las sustancias iónicas, pero la tendencia de las sustancias moleculares es a disolverse en disolventes apolares.
Son blandos.
Las sustancias polares son solubles en disolventes polares que las estabilizan por fuerzas de atracción dipolo-dipolo y tienen mayores puntos de fusión y ebullición al existir atracción electrostática entre las mismas.
Enlace covalente polar
Uniones químicas
8. SÓLIDOS COVALENTES
8.1. Enlaces de las sustancias covalentes.
Las sustancias covalentes son gigantescas agrupaciones de átomos unidos por enlaces covalentes formando sólidos con redes tridimensionales. Dichos átomos deben tener una electronegatividad elevada, junto con la capacidad de tener tres o cuatro electrones enlazantes para formar fuertes enlaces covalentes. Se puede considerar a todo el sólido como una gran molécula.
Ejemplos de estas sustancias son el carbono diamante, el cuarzo (dióxido de silicio), el carburo de Silicio, etc.
8.2. Propiedades de las sustancias covalentes.
Como los átomos están unidos por fuertes enlaces covalentes muy estables, no es de extrañar que:
- estos sólidos sean extremadamente duros,
- tengan puntos de fusión muy altos y sean virtualmente insolubles;
- sólo se disuelvan en compuestos que reaccionen químicamente con ellos.
- Tienen escasa conductividad eléctrica debido a la gran localización de los electrones en las regiones donde se encuentran los enlaces covalentes que hacen que sean incapaces de moverse libremente por la acción de un campo eléctrico externo.
a) Cuarzo:
El cuarzo es una estructura particular de cristalizar el dióxido de silicio. Cada átomo de Si se encuentra enlazado con 4 de O y a su vez cada O está unido a dos Si mediante enlaces covalentes polares, formando una red de gran número de átomos, (SiO2).

b) Carbono diamante:

b) Carbono diamante:
En el carbono diamante, los átomos de carbono se unen para formar un retículo cristalino de dimensiones infinitas, en la que cada uno de ellos se une a otros cuatro mediante enlaces covalentes puros formando estructuras tetraédricas. Esto explica su elevada dureza, su baja reactividad, su nula conductividad eléctrica y su casi infusibilidad.

c) Carbono grafito:

c) Carbono grafito:
Es otra estructura cristalina del carbono. Mientras que el carbono diamante es una red tridimensional, el grafito es un sólido con redes en forma de capa. Contiene agrupaciones de átomos de carbono unidos por enlaces covalentes puros, de dimensiones infinitas, pero en dos direcciones. De los cuatro electrones que tiene cada uno de los átomos de carbono, tres se utilizan para unirlo con un enlace covalente puro a otros tres en un mismo plano formando estructuras hexagonales de seis átomos, y el cuarto electrón está deslocalizado entre los planos tratando de unirlos. En virtud de esta estructura, el carbono grafito es conductor de la electricidad y del calor, carece de la dureza del diamante y se exfolia fácilmente, es decir, se puede laminar.

10. EL ENLACE METÁLICO

10. EL ENLACE METÁLICO
La gran mayoría de los elementos conocidos son metálicos. Todos ellos son conductores del calor y de la electricidad. Se caracterizan por:
- Tener pocos electrones en su última capa.
- Bajo potencial de ionización.
Todavía hoy no se conoce un modelo que explique de forma convincente como se unen los átomos de los metales. Estudios de rayos X confirman que en la red cristalina existen iones. Sin embargo debe descartarse el modelo de enlace iónico porque ello supondría la transferencia de electrones lo cual no es lógico en átomos iguales. Por otra parte el enlace covalente también queda descartado ya que en este caso los e‑ estarían localizados y los metales no conducirían la electricidad lo que no es cierto.
Para explicar los hechos existen dos teorías: el modelo del gas de electrones y la teoría de bandas que detallamos en los apartados 5.2 y 5.3 respectivamente.
10.1. El modelo del gas de electrones.
Es el modelo más sencillo basado en la intuición más que en conocimientos científicos rigurosos y está sustentado en las siguientes hipótesis:
Los átomos metálicos pierden sus electrones de la capa de valencia quedándose cargados positivamente.
Los cationes forman una red tridimensional ordenada y compacta cuya estructura depende en gran medida del tamaño de los cationes del metal.
Los electrones de valencia liberados ya no pertenecen a cada ión sino a toda la red cristalina, rodeando a los cationes como si fuesen un gas de electrones, neutralizando la carga positiva.
El gas de electrones se mueve libremente dentro de la red cristalina de cationes y no puede escapar de ella debido a la atracción electrostática con los cationes.
es decir, el modelo sugiere que los electrones de valencia están totalmente libres y deslocalizados, formando una nube electrónica que interacciona simultáneamente con muchos cationes. Esto explicaría la presencia de iones y la conductividad eléctrica de los metales. Por lo tanto, al hablar de un metal como el Fe, habría que hablar de una gran macromolécula Fen.
10.2. La teoría de bandas.
La teoría de bandas está basada en la mecánica cuántica y procede de la teoría de los orbitales moleculares (TOM). En esta teoría, se considera el enlace metálico como un caso extremo del enlace covalente, en el que los electrones de valencia son compartidos de forma conjunta y simultánea por todos los cationes. Desaparecen los orbitales atómicos y se forman orbitales moleculares con energías muy parecidas, tan próximas entre ellas que todos en conjunto ocupan lo que se franja de denomina una “banda de energía”.
Aunque los electrones van llenando los orbitales moleculares en orden creciente de energía, estas son tan próximas que pueden ocupar cualquier posición dentro de la banda.
La banda ocupada por los orbitales moleculares con los electrones de valencia se llama banda de valencia, mientras que la banda formada por los orbitales moleculares vacíos se llama banda de conducción. A veces, ambas bandas se solapan energéticamente hablando.
Este modelo explica bastante bien el comportamiento eléctrico no solo de las sustancias conductoras sino también de las semiconductoras y las aislantes.
En los metales, sustancias conductoras, la banda de valencia se solapa energéticamente con la banda de conducción que está vacía, disponiendo de orbitales moleculares vacíos que pueden ocupar con un mínimo aporte de energía, es decir, que los electrones están casi libres pudiendo conducir la corriente eléctrica.

En los semiconductores, como el Silicio o el Germanio, la anchura de la banda prohibida no es muy grande y los electrones con suficiente energía cinética pueden pasar a la banda de conducción, por esa razón, los semiconductores conducen la electricidad mejor en caliente. Sin embargo, en los aislantes, la banda prohibida es tan ancha que ningún electrón puede saltarla. La banda de conducción está siempre vacía.
10.3. Propiedades de las sustancias metálicas.
Las propiedades de las sustancias metálicas difieren mucho de unas a otras, pero vamos a hablar en general de todas ellas:
Densidad: El empaquetamiento compacto de los iones en la red cristalina metálica hace que las densidades de los metales sean altas en general, aunque hay mucha diversidad y excepciones, por ejemplo, los metales alcalinos y el plomo son muy blandos, mientras que el osmio y el platino son muy duros. Todos son sólidos excepto el Mercurio, el Cesio y el Francio que son líquidos.
Puntos de fusión y ebullición: En general el enlace metálico mantiene los iones fuertemente unidos dado que la mayoría poseen puntos de fusión y de ebullición muy altos, aunque hay grandes variaciones, desde el cesio, (29ºC), hasta el platino que es casi infusible.
Los puntos de fusión y ebullición dependen en gran medida de dos factores:
Conductividad eléctrica y térmica: Son buenos conductores eléctricos, ya que los electrones de la nube electrónica se pueden mover con total libertad. Por la misma razón, si los metales se calientan, los electrones adquieren mayor energía cinética que se va trasladando por todo el metal.

Brillo: Debido a la movilidad de electrones, son capaces de absorber y después remitir prácticamente todas las longitudes de onda de la luz visible, por eso en general tienen un color negruzco y opaco; el cobre y el oro no remiten una parte de la radiación azul que reciben y por eso tienen un color amarillento.
10.2. La teoría de bandas.
La teoría de bandas está basada en la mecánica cuántica y procede de la teoría de los orbitales moleculares (TOM). En esta teoría, se considera el enlace metálico como un caso extremo del enlace covalente, en el que los electrones de valencia son compartidos de forma conjunta y simultánea por todos los cationes. Desaparecen los orbitales atómicos y se forman orbitales moleculares con energías muy parecidas, tan próximas entre ellas que todos en conjunto ocupan lo que se franja de denomina una “banda de energía”.
Aunque los electrones van llenando los orbitales moleculares en orden creciente de energía, estas son tan próximas que pueden ocupar cualquier posición dentro de la banda.
La banda ocupada por los orbitales moleculares con los electrones de valencia se llama banda de valencia, mientras que la banda formada por los orbitales moleculares vacíos se llama banda de conducción. A veces, ambas bandas se solapan energéticamente hablando.
Este modelo explica bastante bien el comportamiento eléctrico no solo de las sustancias conductoras sino también de las semiconductoras y las aislantes.
En los metales, sustancias conductoras, la banda de valencia se solapa energéticamente con la banda de conducción que está vacía, disponiendo de orbitales moleculares vacíos que pueden ocupar con un mínimo aporte de energía, es decir, que los electrones están casi libres pudiendo conducir la corriente eléctrica.

En los semiconductores y en los aislantes, la banda de valencia no se solapa con la de conducción. Hay una zona intermedia llamada banda prohibida.
En los semiconductores, como el Silicio o el Germanio, la anchura de la banda prohibida no es muy grande y los electrones con suficiente energía cinética pueden pasar a la banda de conducción, por esa razón, los semiconductores conducen la electricidad mejor en caliente. Sin embargo, en los aislantes, la banda prohibida es tan ancha que ningún electrón puede saltarla. La banda de conducción está siempre vacía.
10.3. Propiedades de las sustancias metálicas.
Las propiedades de las sustancias metálicas difieren mucho de unas a otras, pero vamos a hablar en general de todas ellas:
Densidad: El empaquetamiento compacto de los iones en la red cristalina metálica hace que las densidades de los metales sean altas en general, aunque hay mucha diversidad y excepciones, por ejemplo, los metales alcalinos y el plomo son muy blandos, mientras que el osmio y el platino son muy duros. Todos son sólidos excepto el Mercurio, el Cesio y el Francio que son líquidos.
Puntos de fusión y ebullición: En general el enlace metálico mantiene los iones fuertemente unidos dado que la mayoría poseen puntos de fusión y de ebullición muy altos, aunque hay grandes variaciones, desde el cesio, (29ºC), hasta el platino que es casi infusible.
Los puntos de fusión y ebullición dependen en gran medida de dos factores:
- del tamaño: A medida que el tamaño del ion es mayor, el punto de ebullición disminuye.
- del número de electrones cedidos por cada átomo: A medida que el número de electrones cedidos por cada átomo sea mayor, el punto de fusión será más alto.
Nº de electrones enlazantes
| 1 | 2 | 3 |
Elemento: Temperatura de fusión (ºC)
| K : 54 | Ca : 851 | Sc : 1397 |
| Rb : 39 | Sr : 771 | Y : 1277 | |
| Cs : 29 | Ba : 717 | La : 887 |
Propiedades mecánicas: Son dúctiles (se pueden hacer hilos por estiramiento) y maleables (se pueden laminar) debido a la naturaleza de las fuerzas que mantienen unido al sólido, es decir, que siempre que la separación entre los cationes no sea muy grande, la nube electrónica los mantendrá unidos).

Brillo: Debido a la movilidad de electrones, son capaces de absorber y después remitir prácticamente todas las longitudes de onda de la luz visible, por eso en general tienen un color negruzco y opaco; el cobre y el oro no remiten una parte de la radiación azul que reciben y por eso tienen un color amarillento.
Propiedad
|
Sustancias iónicas
|
Sustancias moleculares
|
Sustancias macromoleculares
|
Sustancias metálicas
|
Dureza
|
Duras pero frágiles
|
Blandas
|
Muy duras
|
Duras y blandas (gran variedad)
|
Estado a temperatura ambiente
|
Sólidas
|
Gases, líquidas y sólidas
|
Sólidas
|
Sólidas menos el Hg (líquido)
|
Puntos de fusión
|
Altos
|
Variados sin llegar a ser altos
|
Muy altos
|
Variados pero altos
|
Puntos de ebullición
|
Líquidos en gran rango de temperaturas
|
Líquidos en pequeños rangos de temperatura
|
Muy altos
|
Muy altos
|
Solubilidad en agua
|
Solubles en general
|
Insolubles en general
|
Insolubles
|
Insolubles en general
|
Solubilidad en disolventes apolares
|
Insolubles
|
Solubles en general
|
Insolubles
|
Insolubles
|
Conductividad eléctrica
|
Si disueltos o fundidos; no en estado sólido
|
No
|
No
|
Si
|
Ejemplos
|
NaCl
HgO
MgCO3
|
F2
CO2
CH4
|
Diamante (Cn)
Cuarzo (SiO2)
Carburo de Silicio
|
Aln
Fen
Crn
|
ANIMACIONES

13. MODELOS 3D






Moléculas 3D (World of molecules)
Moléculas 3D (G. Gastebois)
Moléculas activas en 3D
14. PRÁCTICAS
Práctica de enlace químico
15. CUESTIONES
16. OTROS CONTENIDOS
Enlace químico 1
Enlace químico 2
Enlace químico 3
Enlace químico 4
Enlace químico ampliado
Enlace iónico
Enlace metálico
Enlace covalente
Interacciones químicas de no enlace
Enlace químico 5
Enlace químico 6
Enlace químico 7
Enlace químico 8
Enlace químico 9
Resumen enlace químico
17. VÍDEOS
Enlaces químicos
Efecto Meisner
Formación de la molécula de hidrógeno
Hibridación de orbitales. (v.i.)
Tipos de orbitales híbridos
Ensayos a la llama
Teoría de repulsión del par electrónico de la capa de valencia
Enlace químico 1
Enlace químico 2
Enlace químico 3
Enlace químico 4
Enlace químico ampliado
Enlace iónico
Enlace metálico
Enlace covalente
Interacciones químicas de no enlace
Enlace químico 5
Enlace químico 6
Enlace químico 7
Enlace químico 8
Enlace químico 9
Resumen enlace químico
17. VÍDEOS
Enlaces químicos
Efecto Meisner
Formación de la molécula de hidrógeno
Hibridación de orbitales. (v.i.)
Tipos de orbitales híbridos
Ensayos a la llama
Teoría de repulsión del par electrónico de la capa de valencia
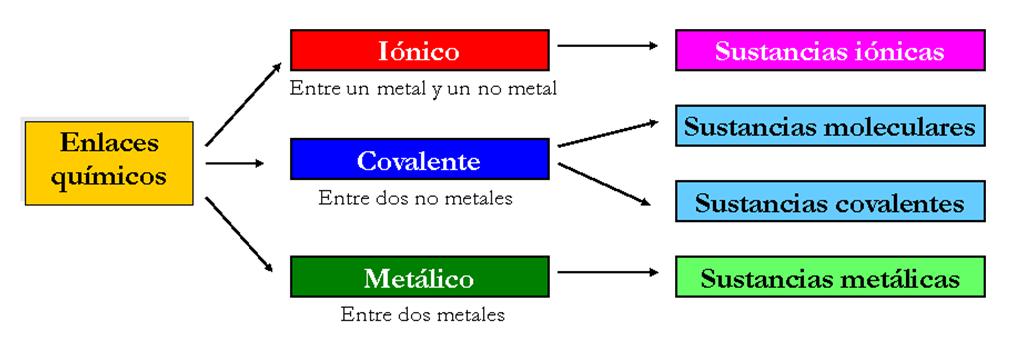












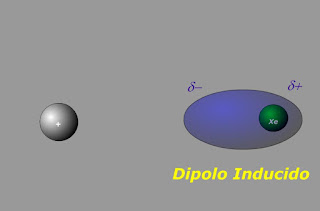

















No hay comentarios:
Publicar un comentario